- Abteilungen
- Max-Planck-Forschungsgruppe Mikrobielle Metabolismen
Max-Planck-Forschungsgruppe Mikrobielle Metabolismen
Gruppenleiter
MPI für Marine Mikrobiologie
Celsiusstr. 1
D-28359 Bremen

Über unsere Forschung
Einige Mikroben, die sogenannten Methanogene, sind in der Lage Methan zu produzieren – ein hochwirksames Treibhausgas und potenter Biokraftstoff. Methanogene atmen keinen Sauerstoff. Stattdessen erhalten sie ihre gesamte Energie über einen Prozess der als Methanogenese bezeichnet wird und 60 Mal weniger chemische Energie (ATP) als Sauerstoffatmung produziert.
Da Methanogenese nicht funktioniert, wenn Sauerstoff vorhanden ist, müssen diese Mikroorganismen in einer sauerstofffreien Umgebung leben, in der chemische Energie sehr begrenzt ist. Trotzdem ist Methanogenese ein hocheffizienter Prozess und die verschiedenen chemischen Reaktionen, die an der Produktion von Methan beteiligt sind, haben sich über die Milliarden von Jahren der Evolution optimiert. Aber nicht nur das: Einige der Methanogene sind vollständig chemoautotroph. Das heißt, sie bilden ihre elementaren Bausteine (DNA, RNA, Proteine, Lipide, Vitamine…) nur über Minerale und Gase – und ganz ohne Licht.
Wegen all dieser Besonderheiten ist das Studium der Methanogene praktisch wie eine offene Tür in die Vergangenheit genauso wie in die Zukunft: Diese Mikroorganismen könnten mit die ersten Lebensformen auf der Erde gewesen sein, weil sie über einen “antiken”, chemoautotrophen Stoffwechsel verfügen. Gleichzeitig können wir sie heute für neue Biotechnologien nutzen, zum Beispiel um Kohlendioxid effizient zu binden und um Methan zu produzieren.
Das Ziel der Forschungsgruppe Mikrobielle Metabolismen ist es auf molekularer Ebene zu verstehen, wie Methanogene in extremen Umwelten überleben und wachsen können. Wie schaffen sie es, aus verschiedenem Kohlenstoff-Quellen so effizient Methan zu produzieren? Wie wandeln sie Minerale in die elementaren Bausteine des Lebens um? Und wie schützen sie sich selbst gegen Stressfaktoren ihrer natürlichen Umwelt?
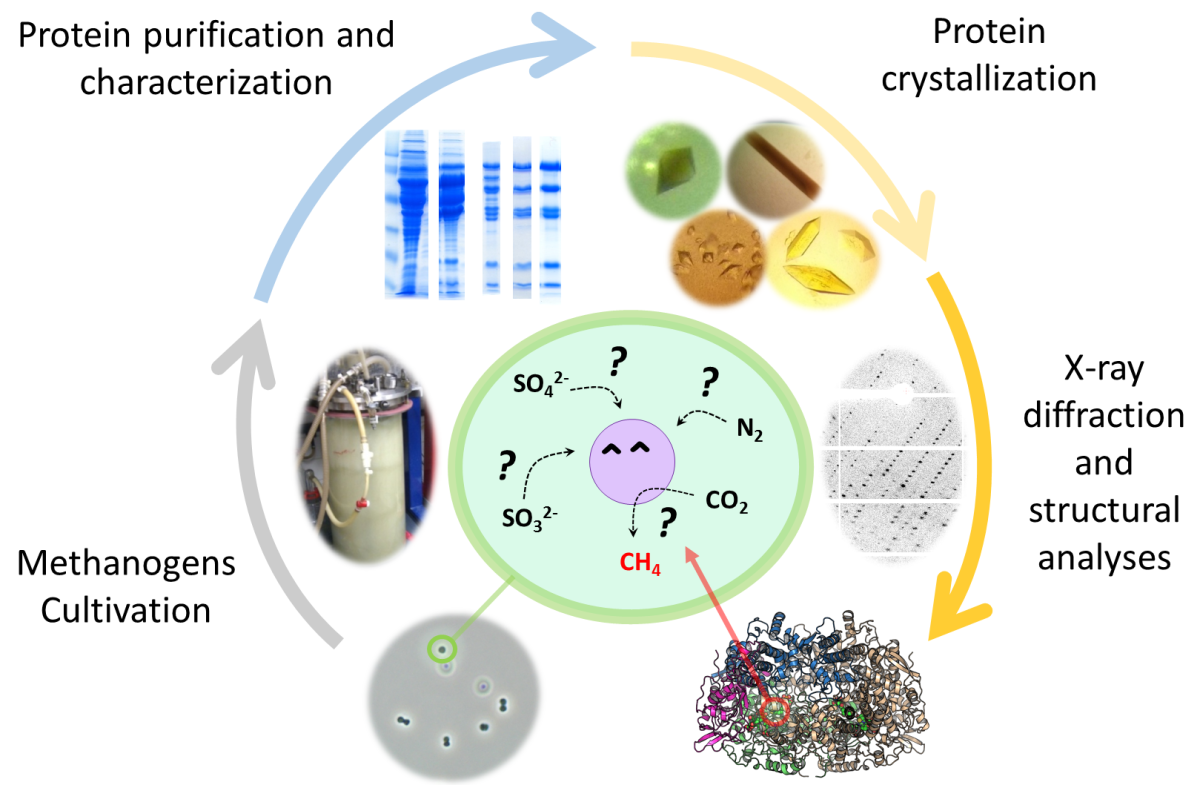
Um Antworten auf all diese Fragen zu finden müssen wir diese Mikroorganismen im Labor kultivieren und die verschiedenen chemischen Reaktionen untersuchen, die in ihnen ablaufen. Die Enzyme, die die Umwandlung von Mineralen und Gasen katalysieren, sind Proteine die fremdartige Reaktionen dirigieren die für Chemikerinnen und Chemiker bisher eine hohe Herausforderung darstellen. Wir entnehmen diese Enzyme und trennen sie von anderen Proteinen, indem wir sie direkt aus dem nativen Organismus aufreinigen. Danach entschlüsseln wir die molekularen Geheimnisse der chemischen Reaktionen via Röntgen-Kristallographie. Das bedeutet, dass wir die Enzyme zunächst kristallisieren müssen, um anschließend Röntgenstrahlen verwenden zu können, die uns Bilder unserer Enzyme liefern.
Wir wollen diese wertvollen Reaktionen, durch die die Methanogene mit einem Minimum an Energie wachsen können, verstehen. Denn sie sind der Schlüssel um im Folgenden diese Geheimnisse für die synthetische Chemie nutzen zu können. Einer unserer Schwerpunkte ist es herauszufinden, wie Methanogene Stickstoff so effizient binden können. Ein Beispiel: Das Binden von Stickstoff, etwa in Düngemitteln und Biokraftstoffen, benötigt rund drei Prozent der weltweiten Energie-Produktion (Haber-Bosch-Prozess). Wenn wir entschlüsseln, wie Methanogene diesen Prozess mit einem minimalen Aufwand an Energie vollführen, können wir darauf aufbauend Katalysatoren entwickeln, um den Haber-Bosch-Prozess zu verbessern.
Während der ersten Zusammenarbeit zwischen Dr. Tristan Wagner und Kolleginnen und Kollegen vom Max-Planck-Institut für Marine Mikrobiologie wurde schnell klar, dass die Verbindung zwischen der Isolierung neuer Mikroorganismen und der Strukturbiologie von Enzymen hervorragend funktioniert. Als biologisches Modell verwendet Wagner Methanothermococcus thermolithotrophicus, ein marines Methanogen. Eine der größten Herausforderungen für die die Forschungsgruppe ist die Kultivierung der Methanogene im Labor: Benötigt werden dafür spezielle Gase, Ausrüstung und – das Wichtigste – das Wissen, was diese Bakterien benötigen, damit sie wachsen und studiert werden können.
Das MPIMM bietet all diese wertvollen technischen Ressourcen genauso wie das notwendige Know-How. Es ist Vorreiter in der Erforschung unbekannter Organismen aus dem tiefen Ozean, einer terra incognita, wo noch viele Entdeckungen auf uns warten. Für Biochemiker wie Tristan Wagner ist das Gold wert und hilft sehr auf der Suche nach unbekannten Stoffwechselwegen und neuen Enzymen von neu beschriebenen Mikroorganismen. Und als Strukturbiologe arbeitet Wagner sehr gerne mit anderen Teams des MPIMM zusammen, um die Stoffwechselwege anderer Gruppen zu beobachten und dabei nach bislang unerforschten Enzymen Ausschau zu halten.
Gleichzeitig soll durch die Zusammenarbeit mit den Menschen im Institut die Perspektive der Forschungsgruppe erweitert werden, um aus der atomaren Welt der Mikroben herauszublicken und das größere Ganze zu sehen. Mit dem Ziel, die Zusammenhänge innerhalb von Ökosystemen und ihre Wechselwirkungen mit sowie ihre Bedeutung für unseren Planeten besser zu verstehen.