- Presse
- Pressemeldungen
- Nahrung aus Gift machen
Nahrung aus Gift machen
Methanogene sind Mikroorganismen, die Methan produzieren, wenn in ihrer Umgebung wenig oder kein Sauerstoff vorhanden ist. Ihre Methanproduktion – zum Beispiel im Verdauungstrakt von Wiederkäuern – ist wichtig für den weltweiten Kohlenstoffkreislauf, da Methan ist ein sehr starkes Treibhausgas ist, aber auch als Energiequelle zum Heizen unserer Häuser genutzt werden kann.
Wachstum auf giftiger Basis
Im Zentrum der jetzt in Nature Chemical Biology veröffentlichten Studie stehen zwei im Meer lebende, wärmeliebende Methanogene: Methanothermococcus thermolithotrophicus (lebt in geothermisch erhitzten Sedimenten bei etwa 65 °C) und Methanocaldococcus jannaschii (lebt an Tiefseevulkanen bei etwa 85 °C). Sie gewinnen ihre Zellenergie, indem sie Methan produzieren, und beziehen Schwefel für ihr Wachstum in Form von Sulfid aus ihrer Umgebung. Für die meisten Organismen ist Sulfid giftig. Für Methanogene jedoch ist es lebensnotwendig und sie vertragen auch hohe Konzentrationen davon. Aber sie haben einen anderen Schwachpunkt: Ihre Achillesferse ist die giftige und reaktionsfreudige Schwefelverbindung Sulfit, die das Enzym zerstört, das für die Methanbildung notwendig ist. Beide untersuchten Organismen treffen in ihrem Lebensraum gelegentlich auf Sulfit, zum Beispiel wenn Sauerstoff eindringt und mit dem reduzierten Sulfid reagiert. Dessen teilweise Oxidation führt zur Bildung von Sulfit, vor dem sich die Methanogenen schützen müssen. Wie machen sie das?
Ein molekularer Schnappschuss des Vorgangs
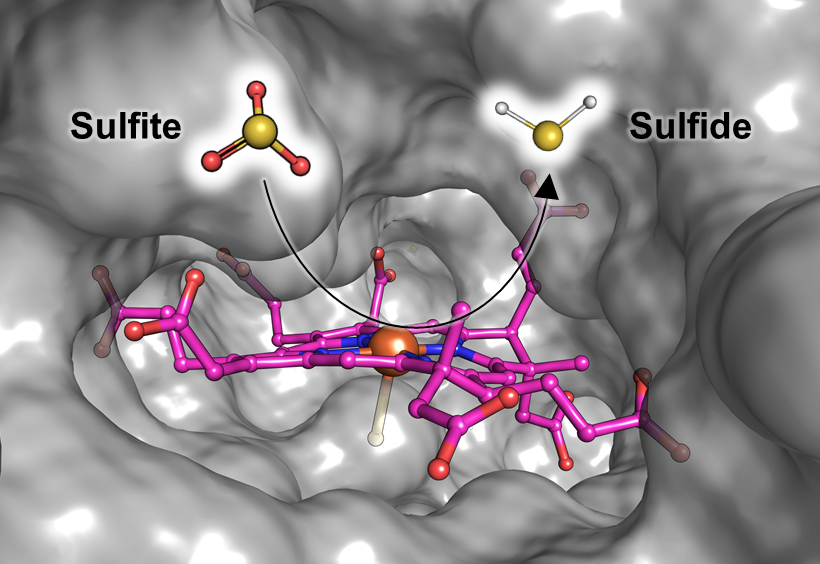
Marion Jespersen und Tristan Wagner vom Max-Planck-Institut für Marine Mikrobiologie in Bremen in Zusammenarbeit mit Antonio Pierik von der Universität Kaiserslautern liefern nun spannende Informationen über das Enzym, das das Sulfit entgiftet. Dieses Enzym, dessen Form ein wenig an einen Schmetterling erinnert, ist bekannt als F420-abhängige Sulfitreduktase oder Fsr. Es kann Sulfit in Sulfid umwandeln – eine sichere Quelle für den Schwefel, den die Methanogenen zum Wachsen benötigen. In der nun vorliegenden Studie beschreiben Jespersen und ihre Kolleginnen und Kollegen, wie das Enzym funktioniert. „Das Enzym fängt das Sulfit ab und reduziert es direkt zu Sulfid, das zum Beispiel in Aminosäuren eingebaut werden kann“, erklärt Jespersen (siehe Abbildung). „Dadurch wird die Mikrobe nicht vergiftet und nutzt das entstehende Produkt sogar als Schwefelquelle. Sie verwandeln Gift in Nahrung!“
Das klingt einfach. Doch tatsächlich handelt es sich um eine faszinierende und komplizierte Verzahnung, stellten Jespersen und Wagner fest. „Es gibt zwei Arten der Sulfitreduktion: die dissimilatorische und die assimilatorische“, erklärt Jespersen. „Der untersuchte Mikroorganismus verwendet ein Enzym, das wie ein dissimilatorisches Enzym aufgebaut ist, aber einen assimilatorischen Mechanismus verwendet. Man könnte sagen, er kombiniert das Beste aus beiden Welten, zumindest für seine Lebensbedingungen.“
Man vermutet, dass beide Enzyme, sowohl die des dissimilatorischen als auch die des assimilatorischen Weges, von einem gemeinsamen Vorfahren abstammen. „Sulfitreduktasen sind uralte Enzyme, die großen Einfluss auf den globalen Schwefel- und Kohlenstoffkreislauf ausüben“, ergänzt Tristan Wagner, Leiter der Max-Planck-Forschungsgruppe Mikrobielle Metabolismen am Max-Planck-Institut in Bremen. „Unser Enzym, das Fsr, ist wahrscheinlich ein Schnappschuss dieses uralten Enzyms, ein spannender Blick zurück in die Evolution.“

Biotechnologische Anwendungen im Blick
Fsr liefert nicht nur Einblicke in die Evolution, sondern erlaubt es uns auch, die faszinierende Welt der Meeresmikroben besser zu verstehen. Methanogene, die nur auf Sulfit wachsen können, vermeiden die Nutzung des gefährlichen Wasserstoffsulfids als Schwefelquelle, welches korrosiv, explosiv und für den Menschen hochgiftig ist. „Dies eröffnet Möglichkeiten für sicherere biotechnologische Anwendungen zur Untersuchung dieser wichtigen Mikroorganismen. Noch besser wäre es, einen methanogenen Mikroorganismus zu finden, der Sulfat reduziert, denn dieses ist billig, reichlich vorhanden und eine völlig sichere Schwefelquelle“, sagt Wagner. Tatsächlich gibt es diesen Organismus bereits, es ist Methanothermococcus thermolithotrophicus. Die Forschenden vermuten, dass Fsr die letzte Reaktion auf diesem Sulfatreduktionsweg orchestriert, da eines seiner Zwischenprodukte Sulfit ist. „Als nächstes wollen wir nun verstehen, wie diese Methanogene Sulfat in Sulfit umwandeln kann, um ein vollständiges Bild von den Fähigkeiten dieser Wundermikroben zu erhalten.“
Originalveröffentlichung
Jespersen, Marion, Pierik, Antonio J. & Wagner, Tristan (2022): Structures of the sulfite detoxifying F420-dependent enzyme from Methanococcales. Nature Chemical Biology.
Beteiligte Institutionen
- Max-Planck-Institut für Marine Mikrobiologie, Bremen, Deutschland
- Universität Kaiserslautern, Kaiserslautern, Deutschland
Rückfragen bitte an:
Gruppenleiter
MPI für Marine Mikrobiologie
Celsiusstr. 1
D-28359 Bremen

Pressereferentin
MPI für Marine Mikrobiologie
Celsiusstr. 1
D-28359 Bremen
|
Raum: |
1345 |
|
Telefon: |
