- Presse
- Pressemeldungen 2020
- Zelluläres Kraftwerk recycelt Industrie-Abgase
Zelluläres Kraftwerk recycelt Industrie-Abgase
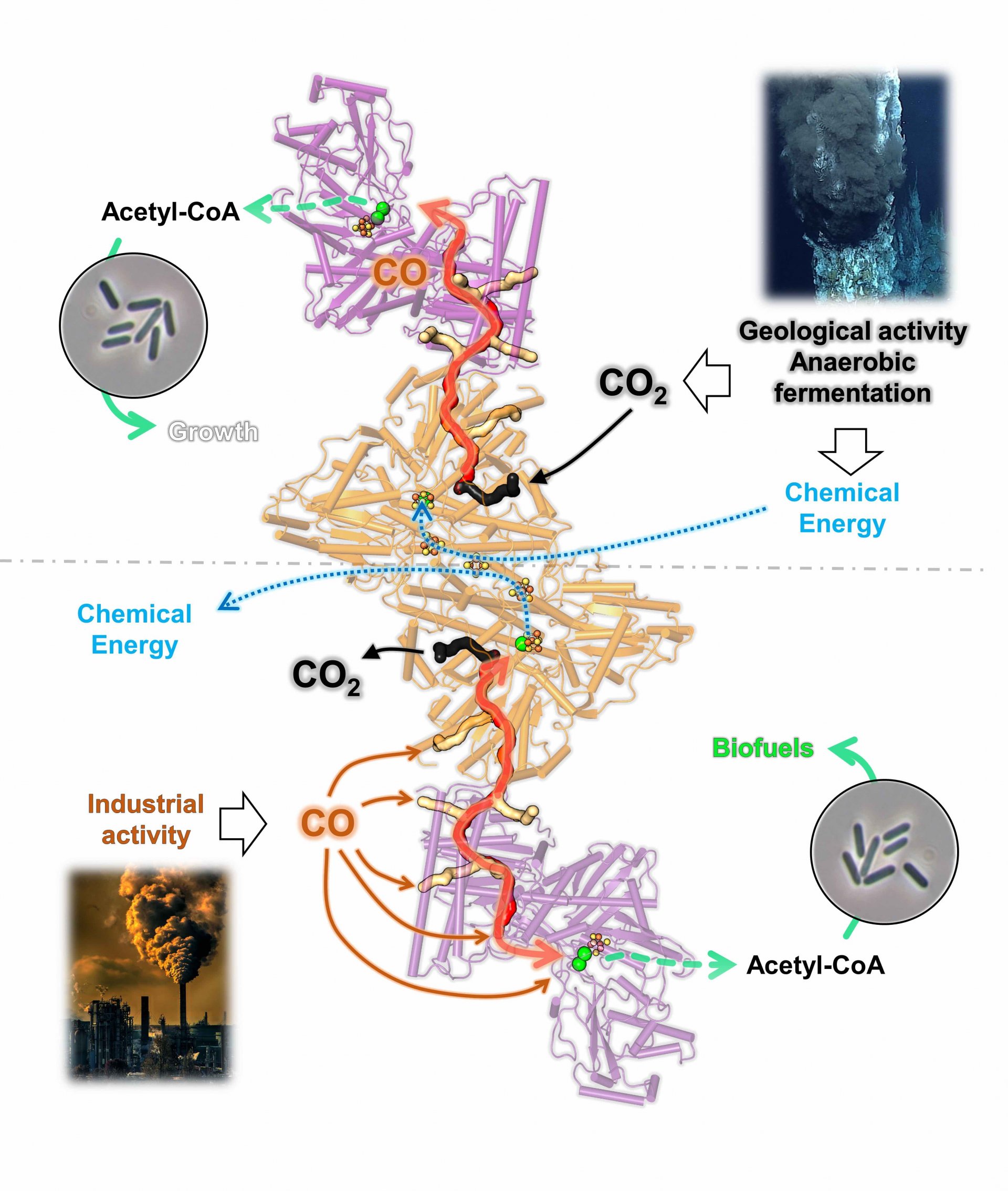
In den Abgasen vieler Industriezweige – zum Beispiel besonders in Stahlhütten – ist jede Menge Kohlenmonoxid und Kohlendioxid enthalten. Momentan werden diese Gase vielerorts noch einfach in die Luft geblasen, doch das kann sich bald ändern. Die Idee ist, die Kraft von Bakterien zu nutzen, um schädliche Abgase in wertvolle Verbindungen wie Acetat oder Ethanol zu verwandeln. Diese können anschließend als Biokraftstoffe oder Grundstoffe für synthetische Materialien verwendet werden. Die ersten Versuchsanlagen werden bereits evaluiert, um diese Umwandlung im industriellen Maßstab zu nutzen. Die Stars dieses Prozesses sind Bakterien wie Clostridium autoethanogenum, die Kohlenmonoxid, Kohlendioxid und Wasserstoff fressen.
„Die wichtigsten Funktionen des Stoffwechsels dieser Bakterien sind weitgehend charakterisiert“, sagt Tristan Wagner, Leiter der Forschungsgruppe Mikrobielle Metabolismen des Max-Planck-Instituts in Bremen. „Aber es gibt immer noch viele Fragezeichen auf molekularer Ebene.“ Und genau diese interessieren die Grundlagenforscher aus Bremen. Aktuell gingen sie der Frage nach: Wie wird das giftige Kohlenmonoxid von Enzymen mit so verblüffender Effizienz verarbeitet?
Kristallisierte Überraschung
Das Wissen auf molekularer Ebene über die Umwandlung von Kohlenmonoxid stammte bisher vorallem aus Studien, die an der Spezies Moorella thermoacetica durchgeführt wurden. Dies ist ein einfacher und gut untersuchter mariner Modellorganismus, der jedoch im Gegensatz zu Clostridium autoethanogenum Abgase nur schlecht entgiften kann. Beide Bakterien verwenden aber das gleiche Enzym zur Umwandlung von Kohlenmonoxid: die CO-Dehydrogenase/Acetyl-CoA-Synthase, abgekürzt CODH/ACS. Es ist ein sehr häufiges Enzym, das bereits in der Urzeit der Erde existierte. „Da beide Spezies dasselbe Enzym zur Umwandlung von Kohlenmonoxid verwenden, erwarteten wir, genau dieselbe Struktur mit eventuell geringfügigen Unterschieden zu sehen“, sagt Wagner.
Für ihre Forschung untersuchten Wagner und sein Kollege Olivier N. Lemaire das Bakterium Clostridium autoethanogenum, um zu verstehen, wie es gedeihen kann, indem es einen Stoffwechsel ähnlich dem der ersten Lebensformen nutzt. Olivier N. Lemaire züchtete die Bakterien und reinigte ihr Enzym CODH/ACS in Abwesenheit von Sauerstoff, da dieser für das Enzym schädlich ist. Die beiden Wissenschaftler verwendeten die Kristallisationsmethode, um Kristalle des Enzyms CODH/ACS zu erhalten und die 3D-Struktur des Proteins mittels Röntgenkristallographie zu bestimmen. „Als wir die Ergebnisse sahen, trauten wir unseren Augen nicht“, sagt Wagner. „Die Schnittstelle im Enzym zwischen CODH und ACS unterscheidet sich bei Clostridium autoethanogenum drastisch vom Modell von Moorella thermoacetica, obwohl es sich um das gleiche Enzym und ähnliche Bakterien handelt.“
Gleiche Zutaten, andere Architektur
Im Folgenden führten die beiden Forscher weitere Experimente durch, um zu beweisen, dass die entdeckte Struktur kein Zufallsprodukt war. Die Ergebnisse bestätigten ihre Entdeckung. Damit widerlegen die Wissenschaftler eindeutig die bisherige Annahme, dass das Enzym CODH/ACS immer die gleiche Gesamtstruktur hat. „Das Enzym von Moorella thermoacetica hat eine lineare Form“, erläutert Olivier N. Lemaire, Erstautor der Studie, die jetzt in der Fachzeitschrift BBA Bioenergetics erschienen ist. „Bei Moorella thermoacetica produziert das Enzym Kohlenmonoxid im CODH und verwendet es im ACS. Zwischen ihnen ist es eingeschlossen und wird durch einen dichten Gaskanal geleitet. Im ACS wird dann Acetyl-CoA synthetisiert, ein Baustein, der zu Acetat und Ethanol weiterverarbeitet wird. Der restliche Teil der Zelle kommt nie mit Kohlenmonoxid in Kontakt.“
Clostridium autoethanogenum nimmt dagegen direkt Kohlenmonoxid auf. „Das Enzym hat in Clostridium autoethanogenum nicht nur eine Öffnung, sondern gleich mehrere. Auf diese Weise kann so viel Kohlenmonoxid wie möglich aufgefangen und in ein ganzes System von Tunneln geleitet werden, die in beide Richtungen verlaufen“, sagt Lemaire. „Diese Ergebnisse zeigen eine Umbildung der internen Gaskanäle während der Evolution dieser Bakterien. Entstanden ist ein Komplex mit Gaskanälen in beide Richtungen, der die ständige Aufnahme von Kohlenmonoxid sowie eine hohe Umwandlung des Gases für die Energieerhaltung gewährleistet. Das Enzym fungiert so als wichtigstes Zellkraftwerk.“ Als Endprodukte entstehen dann auch bei Clostridium autoethanogenum Azetate und Ethanol, die zu Treibstoff weiterverarbeitet werden können.
„Wir haben jetzt eine Vorstellung davon, wie dieses sehr effiziente und robuste Enzym aussieht“, sagt Tristan Wagner. „Aber unsere Entdeckung ist nur ein weiterer Schritt. Unter anderem ist es immer noch eine offene Frage, wie das Bakterium überleben und Kohlenmonoxid nutzen kann, um seinen gesamten zellulären Energiebedarf zu decken. Wir haben einige Hypothesen, stehen aber noch am Anfang. Um den gesamten chemischen Prozess der Umwandlung von Kohlenmonoxid in Acetat und Ethanol zu verstehen, müssen weitere Proteine untersucht werden.“
Originalveröffentlichung
Olivier N. Lemaire and Tristan Wagner: Gas channel rerouting in a primordial enzyme: Structural insights of the carbon-monoxide dehydrogenase/acetyl-CoA synthase complex from the acetogen Clostridium autoethanogenum. BBA – Bioenergetics, 2020
Rückfragen bitte an:
Gruppenleiter
MPI für Marine Mikrobiologie
Celsiusstr. 1
D-28359 Bremen

