Seitenpfad:
- Presse
- Pressemeldungen 2012
- 04.05.2012 Algenblüten in der Nordsee
04.05.2012 Algenblüten in der Nordsee
Algenblüten, damit verbinden die meisten Menschen eine Beeinträchtigung sommerlicher Badefreuden. In der Küstenzone gemäßigter Breiten wie der deutschen Bucht ist eine Frühjahrsalgenblüte jedoch kein Anzeichen übermäßigen Nährstoffeintrags, sondern vor allem Folge der intensiveren Sonneneinstrahlung im Frühjahr (Abbildung 1). Frühjahrsalgenblüten sind in diesen Gewässern also ganz natürlich (Abbildung 2). Wenn Algenblüten enden, sterben die Algen ab, und ihre Überreste bilden eine wichtige Nährstoffzufuhr für das gesamte Ökosystem. Dieser Prozess ist z.B. maßgeblich für den Fischreichtum vor Küsten. Was aber geschieht genau, wenn eine Algenblüte endet? Eine überraschende und sehr detaillierte Antwort liefern jetzt Hanno Teeling und Bernhard Fuchs mit ihren Kollegen vom Max-Planck-Institut in Bremen sowie der Universität Greifswald, der Jacobs University und dem Alfred-Wegener-Institut für Polar- und Meeresforschung. Sie haben eine Frühjahrsblüte in der Nordsee genau untersucht, und konnten identifizieren, welche Mikroorganismen beim Abbau der Algenüberreste eine Rolle spielen. Dabei haben sie entdeckt, dass einige Abbauprozesse vermutlich anders ablaufen als bisher angenommen (Abbildung 3). Ihre Ergebnisse veröffentlichten sie jetzt im Wissenschaftsmagazin Science.
Abbildung 1: Die Algenblüte in der Deutschen Bucht breitet sich vor der ost- und westfriesischen Küste aus. Auf der Satellitenaufnahme von 2011 ist auch zu erkennen, dass sie sich an der Küste mit dem von den Flüssen Elbe und Weser mitgeführten Sediment vermischt. Die Insel Helgoland ist mit einem gelben Kreis markiert. © NASA images courtesy Jeff Schmaltz, MODIS Rapid Response Team, Goddard Space Flight Center.
Für ihre Analysen filtrierten die Wissenschaftler über fast ein Jahr regelmäßig mehrere hundert Liter Wasser von der Station „Kabeltonne“, einer Langzeitstation der Biologischen Anstalt Helgoland, die zum Alfred-Wegener-Insitut gehört. Hanno Teeling vom Max-Planck-Institut sagt: „Freilebende Kleinstlebewesen, das sogenannte Bakterioplankton, sind entscheidend beim Abbau der abgestorbenen Algenbiomasse. Uns fiel besonders eine dynamische Folge in der Bakterioplankton-Population auf. Spezialisierten Bakterienpopulationen begleiten verschiedene Phasen der Algenblüte“. Wie die Forscher jetzt zeigen konnten, steuern Prozesse innerhalb der Bakterienpopulation den Abbau der Algen.
Sein Kollege Bernhard Fuchs, der am Max-Planck-Institut seit vielen Jahren die Diversität und die Zusammensetzung von Bakterioplankton erforscht, ergänzt: „Zum ersten Mal haben wir eine zeitlich hochauflösende Analyse der mikrobiellen Gemeinschaft auf Gattungsebene durchgeführt. Nicht nur die Bakteriengruppen, sondern auch deren Werkzeuge, die Enzyme, die am Abbau der Algenblüte beteiligt sind, konnten wir jetzt identifizieren“.
Sein Kollege Bernhard Fuchs, der am Max-Planck-Institut seit vielen Jahren die Diversität und die Zusammensetzung von Bakterioplankton erforscht, ergänzt: „Zum ersten Mal haben wir eine zeitlich hochauflösende Analyse der mikrobiellen Gemeinschaft auf Gattungsebene durchgeführt. Nicht nur die Bakteriengruppen, sondern auch deren Werkzeuge, die Enzyme, die am Abbau der Algenblüte beteiligt sind, konnten wir jetzt identifizieren“.
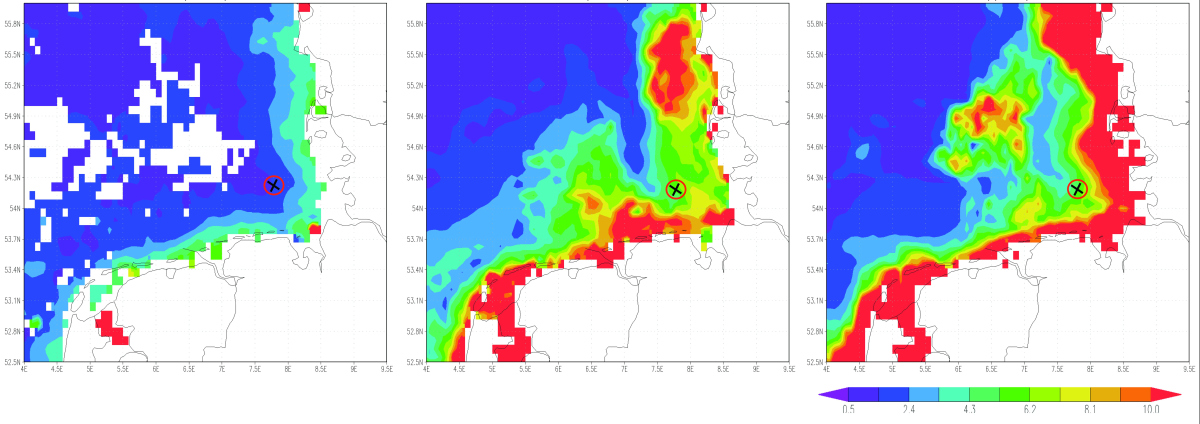
Abbildung 2: Der Chlorophyll a-Gehalt, ein Maß für die Anwesenheit für Algen im Wasser, nahm im Jahr 2009, in dem die Proben genommen wurden, von Februar (linkes Bild) bis April (rechtes Bild) stetig zu. Anfang April erreichte die Algenblüte, die hauptsächlich aus Kieselalgen (Diatomeen) bestand, ihren Höhepunkt und wurde danach abgebaut. Helgoland (rot-schwarze Markierung) liegt zentral im Bereich der Algenblüte. Satellitendaten: © Giovanni online data system, developed and maintained by the NASA GES DISC
Neu war auch die Kombination der Technologien, die die Forscher für ihre Analysen angewandt haben. Die Identität der Mikroorganismen haben sie mit CARD-FISH, einer in situ-Technologie, die direkt auf Umweltproben angewandt werden kann, festgestellt (Abbildung 4). Zusätzlich haben sie während und nach der Algenblüte die Zusammensetzung der Bakterienpopulation untersucht, indem sie kurze Abschnitte eines stammesgeschichtlichen Markergens verglichen (16S rRNA-Pyrotag-Analysen). „Durch eine Kombination von Metagenom- und Metaproteom-Analysen gelang es uns, aktive Schlüsselenzyme in den komplexen Umweltproben nachzuweisen. Damit können wir Rückschlüsse von der metabolischen Funktion auf die Aufgabe der einzelnen Bakteriengruppen ziehen“, erklärt Thomas Schweder von der Universität Greifswald. "Dies war nur über eine Integration aller Daten möglich. Das haben wir mit bioinformatischen Methoden gelöst", so Frank Oliver Glöckner vom Max-Planck-Institut und von der Jacobs University. In der frühen Phase der Algenblüte fanden die Wissenschaftler vermehrt Enzyme zum Abbau komplexer Algen-Kohlenhydrate wie Laminarin. Später dominierten Transportproteine für Peptide, also kurze Proteinstücke, sowie Transporter für den wachstumsbegrenzenden Nährstoff Phosphat. Auffällig war der hohe Anteil bestimmter Transportproteine, der sogenannten TonB-abhängigen Transporter, die größere Moleküle direkt ins Zellinnere transportieren können. Diese Entdeckung könnte die herkömmliche Annahme widerlegen, dass längerkettige Moleküle vor der Aufnahme in die Zelle in Einzelbausteine zerlegt werden müssen. Die TonB-Transporter erlauben so möglicherweise den Flavobakterien, eine der dominierenden Bakteriengruppen, die Aufnahme und den Abbau von längeren Kohlenhydratketten zu koppeln und dadurch einen Wettbewerbsvorteil gegenüber anderen Bakteriengruppen zu erlangen. Am Ende der Blüte bildeten die Bakterien Sulfatasen, die Sulfatester aus schwer abbaubaren Algen-Kohlehydraten abspalten und so ihren kompletten Abbau ermöglichen. Die Wissenschaftler fanden in der Algenblüte also eine Bakterienpopulation vor, die sich nicht nur in der Zusammensetzung, sondern auch in der Funktion vollständig von der Bakteriengemeinschaft kristallklarer küstenferner Gewässer unterscheidet.
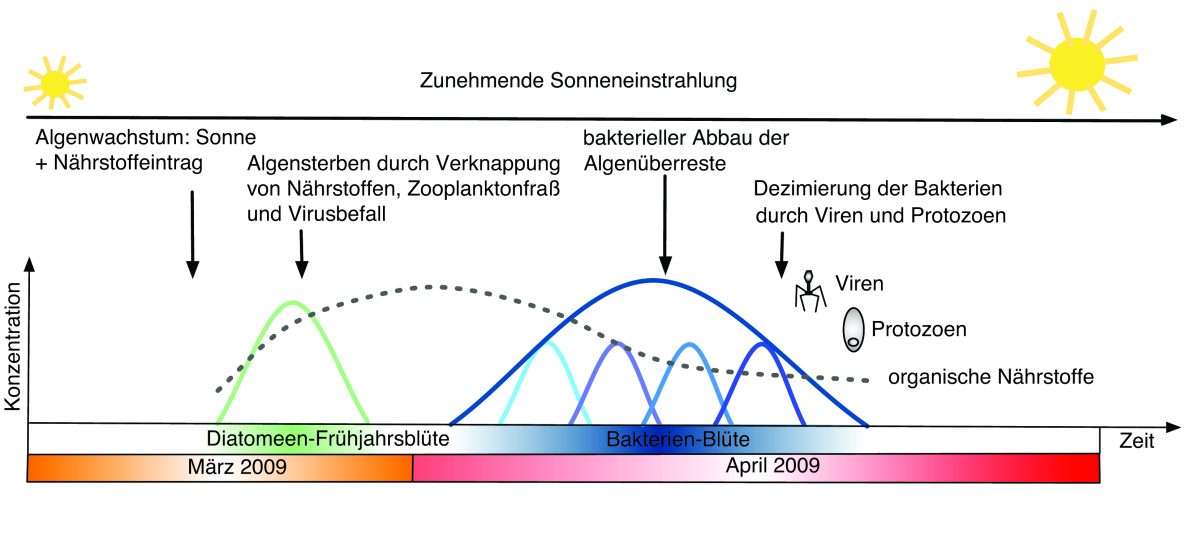
Abbildung 3: Schema zum Verlauf der Algen-Bakterieninteraktion im Frühjahr 2009. Nur knapp zwei Monate dauert es, bis eine Algenblüte entsteht und durch die darauffolgende Bakterioplanktonblüte vollständig abgebaut wird. Die Entstehung der Blüte ist stark an die im Frühjahr stärker werdende Sonneneinstrahlung gekoppelt. Nicht nur Bakterien, sondern auch Viren und einzellige Tiere, die Protozoen, helfen beim Abbau der Blüte. Viren und Protozoen sind es auch, die später der Bakterienblüte ein Ende bereiten. © H. Teeling/R. Dunker
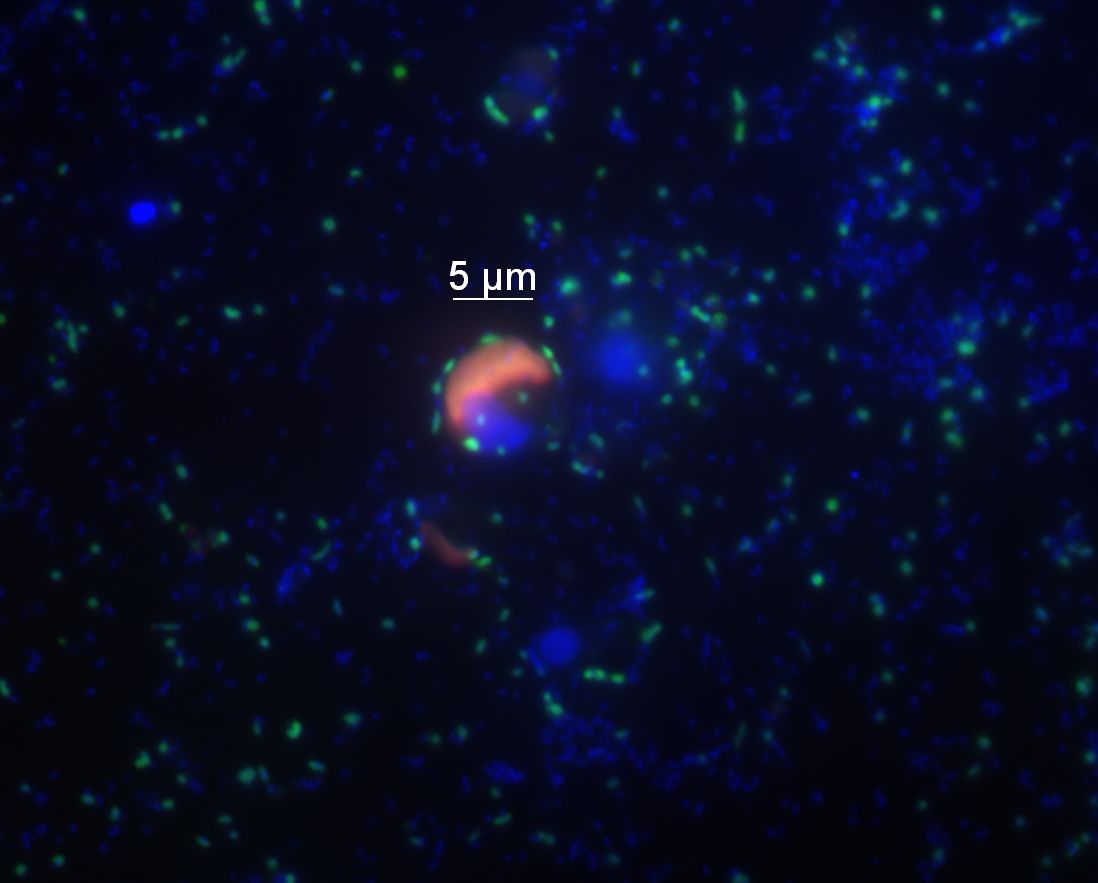
Abbildung 4: Flavobakterien (grün) kommen in den Nordseegewässern sowohl einzeln als auch an Mikroalgen gebunden vor. Hier haben sich einige Flavobakterienzellen an eine Mikroalgenzelle (deren Chloroplast rot erscheint) angelagert. Alle anderen Zellen sind blau dargestellt. Die Technik der Fluoreszenz in situ Hybridisierung, die für diese Aufnahme verwendet wurde, erlaubt es, Bakterien direkt in der Probe sichtbar zu machen, ohne sie zuvor kultivieren zu müssen. © P. Gomez-Perreira/B. Fuchs
Die Ergebnisse der Studie weisen den Forschern den Weg, das sogenannte Plankton-Paradox zu erklären: Wie können so viele Plankton-Arten in einem scheinbar homogenen Umfeld leben, ohne dass diese so stark miteinander in Konkurrenz um die Nährstoffe treten, dass bestimmte Arten verdrängt werden? Rudolf Amann, Direktor des Max-Planck-Instituts in Bremen erklärt: „Auf der Ebene der Mikroorganismen ist das Geheimnis die Heterogenität der Mikronischen, die die unterschiedlichen Gruppen besiedeln. Dadurch ergänzen sich die spezialisierten Populationen optimal beim Abbau des organischen Materials.“
Rita Dunker
Rückfragen an
Dr. Hanno Teeling: [Bitte aktivieren Sie Javascript]
Dr. Bernhard Fuchs: [Bitte aktivieren Sie Javascript]
Prof. Dr. Rudolf Amann: [Bitte aktivieren Sie Javascript]
Prof. Dr. Thomas Schweder: [Bitte aktivieren Sie Javascript]
Oder an die Pressesprecher
Rita Dunker: [Bitte aktivieren Sie Javascript]
Manfred Schlösser: [Bitte aktivieren Sie Javascript]
Originalarbeit
Substrate-controlled succession of marine bacterioplankton populations induced by a phytoplankton blom, 2012. H. Teeling, B. M. Fuchs, D. Becher, C. Klockow, A. Gardebrecht, C. M. Bennke, M. Kassabgy, S. Huang, A. J. Mann, J. Waldmann, M. Weber, A. Klindworth, A. Otto, J. Lange, J. Bernhardt, C. Reinsch, M. Hecker, J. Peplies, F. D. Bockelmann, U. Callies, G. Gerdts, A. Wichels, K. H. Wiltshire, F. O. Glöckner, T. Schweder, and R. Amann. Science, 336: 608-611.
Beteiligte Institute
Max-Planck-Institut für Marine Mikrobiologie, Bremen
Institut für Marine Biotechnologie e.V., Greifswald
Jacobs University Bremen, Bremen
Alfred-Wegener-Institut für Polar- und Meeresforschung, Biologische Anstalt Helgoland, Helgoland
Institut für Mikrobiologie, Ernst-Moritz-Arndt Universität, Greifswald
Pharmazeutische Biotechnologie, Ernst-Moritz-Arndt
Universität, Greifswald
DECODON GmbH, Greifswald
Ribocon GmbH, 28359 Bremen
Helmholtz-Zentrum Geesthacht, Zentrum für Materialforschung und Küstenforschung, Geesthacht
Rita Dunker
Rückfragen an
Dr. Hanno Teeling: [Bitte aktivieren Sie Javascript]
Dr. Bernhard Fuchs: [Bitte aktivieren Sie Javascript]
Prof. Dr. Rudolf Amann: [Bitte aktivieren Sie Javascript]
Prof. Dr. Thomas Schweder: [Bitte aktivieren Sie Javascript]
Oder an die Pressesprecher
Rita Dunker: [Bitte aktivieren Sie Javascript]
Manfred Schlösser: [Bitte aktivieren Sie Javascript]
Originalarbeit
Substrate-controlled succession of marine bacterioplankton populations induced by a phytoplankton blom, 2012. H. Teeling, B. M. Fuchs, D. Becher, C. Klockow, A. Gardebrecht, C. M. Bennke, M. Kassabgy, S. Huang, A. J. Mann, J. Waldmann, M. Weber, A. Klindworth, A. Otto, J. Lange, J. Bernhardt, C. Reinsch, M. Hecker, J. Peplies, F. D. Bockelmann, U. Callies, G. Gerdts, A. Wichels, K. H. Wiltshire, F. O. Glöckner, T. Schweder, and R. Amann. Science, 336: 608-611.
Beteiligte Institute
Max-Planck-Institut für Marine Mikrobiologie, Bremen
Institut für Marine Biotechnologie e.V., Greifswald
Jacobs University Bremen, Bremen
Alfred-Wegener-Institut für Polar- und Meeresforschung, Biologische Anstalt Helgoland, Helgoland
Institut für Mikrobiologie, Ernst-Moritz-Arndt Universität, Greifswald
Pharmazeutische Biotechnologie, Ernst-Moritz-Arndt
Universität, Greifswald
DECODON GmbH, Greifswald
Ribocon GmbH, 28359 Bremen
Helmholtz-Zentrum Geesthacht, Zentrum für Materialforschung und Küstenforschung, Geesthacht