Seitenpfad:
- Presse
- Pressemeldungen 2012
- 17.04.2012 Giftiger Speiseplan
17.04.2012 Giftiger Speiseplan
Giftiger Speiseplan
Meereswurm ernährt sich mit Hilfe symbiontischer Bakterien von Kohlenmonoxid und Schwefelwasserstoff
Wissenschaftler vom Max-Planck-Institut für marine Mikrobiologie in Bremen und der Universität Greifswald haben zusammen mit ihren Kollegen aus Freiburg, Italien und den USA in einer in der Fachzeitschrift Proceedings of the National Academy of Science veröffentlichten Studie zeigen können, dass ein kleiner Meereswurm, dessen natürliches Nahrungsangebot im sandigen Sediment vor der Küste Elbas doch äußerst bescheiden ist, tödliches Gift auf seinem Speiseplan hat: der Wurm verzehrt Kohlenmonoxid und Schwefelwasserstoff.
Der Wurm, mit dem Namen Olavius algarvensis, kann auf diesen Giften gedeihen dank Millionen symbiontischer Bakterien, die unter seiner Haut leben. Diese nutzen die Energie aus Kohlenmonoxid und Schwefelwasserstoff, um Nahrung für den Wurm zu produzieren. Dabei arbeiten die Bakterien ähnlich wie Pflanzen. Doch während Pflanzen die Energie des Sonnenlichts nutzen, um aus Kohlendioxid und Wasser Kohlenhydrate herzustellen, verwenden die Bakterien die Energie aus chemischen Verbindungen. „Sie sind dabei so effektiv, dass der Wurm im Laufe der Evolution seinen kompletten Verdauungsapparat inklusive Mund und Darm aufgegeben hat und sich nur über die Symbionten ernährt“, erklärt Nicole Dubilier, Leiterin der Arbeitsgruppe Symbiose am Bremer Max-Planck-Institut.
Doch Kohlenmonoxid und Schwefelwasserstoff sind bei weitem nicht die einzigen Energiequellen. Manche der symbiontischen Bakterien im Wurm können Wasserstoff und organische Nährstoffe aus der Umgebung aufnehmen, selbst wenn diese nur in verschwindend geringen Mengen vorhanden sind. Und Olavius algarvensis hat noch weitere Tricks auf Lager, um in seiner nahrungsarmen Umwelt zu überleben: Im Gegensatz zu den meisten Tieren, die manche Stoffwechselprodukte nicht weiterverwerten können und sie deshalb ausscheiden müssen, kann der Wurm viele seiner „Abfallprodukte“ weiter nutzen. Wie die Forscher zeigen konnten, sind es wiederum die symbiontischen Mikroorganismen, die dieses ermöglichen. Sie sind regelrechte Meister in der Wiederverwertung von Produkten, die für sie noch viel Energie enthalten, für den Wurm selber aber nicht mehr verwertbar sind. „Der Wurm kann deshalb nicht nur auf seinen Verdauungsapparat, sondern auch auf seine Ausscheidungsorgane verzichten“, betont Dubilier, „was bisher von keinem einzigen anderen Meerestier bekannt ist.“
Für ihre Analysen verwendeten die Forscher eine Kombination von modernsten Techniken wie Metaproteomik und Metabolomik, die es ermöglichen, einen großen Teil der Proteine und der Stoffwechselprodukte in einem Organismus zu analysieren. Die Metaproteom-Analyse war eine besondere Herausforderung, da die Forscher dabei die Zellen der Symbionten und des Wirts trennen mussten. Thomas Schweder vom Institut für Pharmazie an der Universität Greifswald erklärt: „Mit der Metaproteomik konnten wir tausende Proteine identifizieren und den einzelnen Symbiose-Partnern zuordnen. Das ermöglichte uns einen direkten Einblick in den Stoffwechsel der bakteriellen Symbionten und deren Interaktionen mit dem Wirt.“
Meereswurm ernährt sich mit Hilfe symbiontischer Bakterien von Kohlenmonoxid und Schwefelwasserstoff
Wissenschaftler vom Max-Planck-Institut für marine Mikrobiologie in Bremen und der Universität Greifswald haben zusammen mit ihren Kollegen aus Freiburg, Italien und den USA in einer in der Fachzeitschrift Proceedings of the National Academy of Science veröffentlichten Studie zeigen können, dass ein kleiner Meereswurm, dessen natürliches Nahrungsangebot im sandigen Sediment vor der Küste Elbas doch äußerst bescheiden ist, tödliches Gift auf seinem Speiseplan hat: der Wurm verzehrt Kohlenmonoxid und Schwefelwasserstoff.
Der Wurm, mit dem Namen Olavius algarvensis, kann auf diesen Giften gedeihen dank Millionen symbiontischer Bakterien, die unter seiner Haut leben. Diese nutzen die Energie aus Kohlenmonoxid und Schwefelwasserstoff, um Nahrung für den Wurm zu produzieren. Dabei arbeiten die Bakterien ähnlich wie Pflanzen. Doch während Pflanzen die Energie des Sonnenlichts nutzen, um aus Kohlendioxid und Wasser Kohlenhydrate herzustellen, verwenden die Bakterien die Energie aus chemischen Verbindungen. „Sie sind dabei so effektiv, dass der Wurm im Laufe der Evolution seinen kompletten Verdauungsapparat inklusive Mund und Darm aufgegeben hat und sich nur über die Symbionten ernährt“, erklärt Nicole Dubilier, Leiterin der Arbeitsgruppe Symbiose am Bremer Max-Planck-Institut.
Doch Kohlenmonoxid und Schwefelwasserstoff sind bei weitem nicht die einzigen Energiequellen. Manche der symbiontischen Bakterien im Wurm können Wasserstoff und organische Nährstoffe aus der Umgebung aufnehmen, selbst wenn diese nur in verschwindend geringen Mengen vorhanden sind. Und Olavius algarvensis hat noch weitere Tricks auf Lager, um in seiner nahrungsarmen Umwelt zu überleben: Im Gegensatz zu den meisten Tieren, die manche Stoffwechselprodukte nicht weiterverwerten können und sie deshalb ausscheiden müssen, kann der Wurm viele seiner „Abfallprodukte“ weiter nutzen. Wie die Forscher zeigen konnten, sind es wiederum die symbiontischen Mikroorganismen, die dieses ermöglichen. Sie sind regelrechte Meister in der Wiederverwertung von Produkten, die für sie noch viel Energie enthalten, für den Wurm selber aber nicht mehr verwertbar sind. „Der Wurm kann deshalb nicht nur auf seinen Verdauungsapparat, sondern auch auf seine Ausscheidungsorgane verzichten“, betont Dubilier, „was bisher von keinem einzigen anderen Meerestier bekannt ist.“
Für ihre Analysen verwendeten die Forscher eine Kombination von modernsten Techniken wie Metaproteomik und Metabolomik, die es ermöglichen, einen großen Teil der Proteine und der Stoffwechselprodukte in einem Organismus zu analysieren. Die Metaproteom-Analyse war eine besondere Herausforderung, da die Forscher dabei die Zellen der Symbionten und des Wirts trennen mussten. Thomas Schweder vom Institut für Pharmazie an der Universität Greifswald erklärt: „Mit der Metaproteomik konnten wir tausende Proteine identifizieren und den einzelnen Symbiose-Partnern zuordnen. Das ermöglichte uns einen direkten Einblick in den Stoffwechsel der bakteriellen Symbionten und deren Interaktionen mit dem Wirt.“
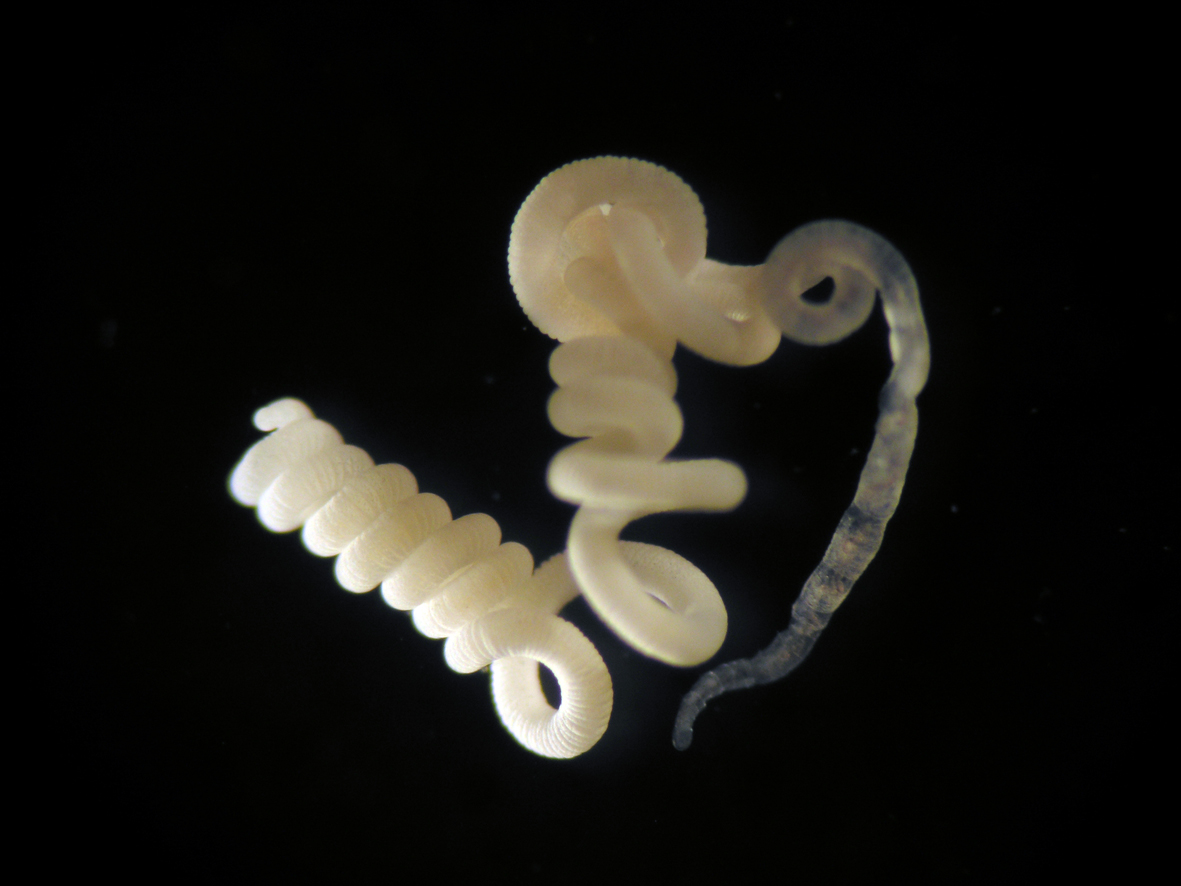
Der Wurm Olavius algarvensis unter dem Lichtmikroskop. Dank seiner Symbionten kann er in den nahrungsarmen sandigen Sedimenten gedeihen. (Quelle des Photos: C. Lott/HYDRA/ Max-Planck-Institut für Marine Mikrobiologie, Bremen)
Im flachen Wasser vor der Küste Elbas konnten die Taucher den Lebensraum von Olavius algarvensis gut studieren. (Quelle des Photos: C. Lott/HYDRA/ Max-Planck-Institut für Marine Mikrobiologie, Bremen)
Die Forscher waren höchst erstaunt, als sie bei ihren Analysen feststellten, dass der Wurm in großen Mengen Proteine für die Verwertung von Kohlenmonoxid als Energiequelle besitzt. „Wir konnten uns kaum vorstellen, dass Kohlenmonoxid im sandigen Sediment vor der Küste Elbas vorkommt“, sagt Manuel Kleiner, Doktorand in der Max-Planck-Arbeitsgruppe, „also sind wir hingefahren und mussten zu unserer Überraschung feststellen, dass dort tatsächlich ungewöhnlich hohe Konzentrationen an Kohlenmonoxid in den Meeressedimenten auftreten.“
Nicole Dubilier beschäftigt sich seit über 15 Jahren mit dem Wurm: „Wir wissen seit längerem, dass die symbiontischen Bakterien in Olavius algarvensis in einem Wechselspiel miteinander die energiereichen Schwefelverbindungen für den Wurm nutzen können.“ Aber erst jetzt konnten die Forscher weitere Stoffwechselwege entschlüsseln – und neue Energiequellen ausfindig machen. Die Studie unterstreicht, wie wichtig es ist, metagenomische Analysen durch Metaproteomik und Metabolomik zu ergänzen. „Der Wurm dient uns als Beispiel für die Kraft der Evolution. Durch Anpassung und Selektion hat sich im Laufe von Millionen Jahren ein optimal angepasstes Wirt-Symbionten-System entwickelt. Und wenn wir andere komplexen Symbiosen, wie die im menschlichen Darm, verstehen wollen, könnten diese scheinbar schlichten Meereswürmer ein gutes Modellsystem sein“, so Dubilier.
Nicole Dubilier beschäftigt sich seit über 15 Jahren mit dem Wurm: „Wir wissen seit längerem, dass die symbiontischen Bakterien in Olavius algarvensis in einem Wechselspiel miteinander die energiereichen Schwefelverbindungen für den Wurm nutzen können.“ Aber erst jetzt konnten die Forscher weitere Stoffwechselwege entschlüsseln – und neue Energiequellen ausfindig machen. Die Studie unterstreicht, wie wichtig es ist, metagenomische Analysen durch Metaproteomik und Metabolomik zu ergänzen. „Der Wurm dient uns als Beispiel für die Kraft der Evolution. Durch Anpassung und Selektion hat sich im Laufe von Millionen Jahren ein optimal angepasstes Wirt-Symbionten-System entwickelt. Und wenn wir andere komplexen Symbiosen, wie die im menschlichen Darm, verstehen wollen, könnten diese scheinbar schlichten Meereswürmer ein gutes Modellsystem sein“, so Dubilier.
Rückfragen an
Manuel Kleiner, Diplom-Biologe
Max-Planck-Institut für Marine Mikrobiologie
Celsiusstraße 1
D-28359 Bremen
Telefon +49 421 2028 905
[Bitte aktivieren Sie Javascript]
Prof. Dr. Nicole Dubilier
Max-Planck-Institut für Marine Mikrobiologie
Celsiusstraße 1
D-28359 Bremen
Telefon +49 421 2028 932
[Bitte aktivieren Sie Javascript]
Prof. Dr. Thomas Schweder
Institut für Pharmazie
Ernst-Moritz-Arndt-Universität Greifswald
Friedrich-Ludwig-Jahn-Straße 17
D-17489 Greifswald
Telefon +49 3834 864212
[Bitte aktivieren Sie Javascript]
Oder die Pressesprecher
Dr. Manfred Schlösser
Telefon +49 421 2028704
[Bitte aktivieren Sie Javascript]
und Dr. Rita Dunker
Telefon +49 421 2028 856
[Bitte aktivieren Sie Javascript]
Originalartikel:
Metaproteomics of a gutless marine worm and its symbiotic microbial community reveal unusual pathways for carbon and energy use
Manuel Kleiner , Cecilia Wentrup, Christian Lott, Hanno Teeling, Silke Wetzel, Jacque Young, Yun-Juan Chang, Manesh Shah, Nathan C. VerBerkmoes, Jan Zarzycki, Georg Fuchs, Stephanie Markert, Kristina Hempel, Birgit Voigt, Dörte Becher, Manuel Liebeke, Michael Lalk, Dirk Albrecht, Michael Hecker, Thomas Schweder, Nicole Dubilier
Proceedings of the National Academy of Science
doi/10.1073/pnas.1121198109
Manuel Kleiner, Diplom-Biologe
Max-Planck-Institut für Marine Mikrobiologie
Celsiusstraße 1
D-28359 Bremen
Telefon +49 421 2028 905
[Bitte aktivieren Sie Javascript]
Prof. Dr. Nicole Dubilier
Max-Planck-Institut für Marine Mikrobiologie
Celsiusstraße 1
D-28359 Bremen
Telefon +49 421 2028 932
[Bitte aktivieren Sie Javascript]
Prof. Dr. Thomas Schweder
Institut für Pharmazie
Ernst-Moritz-Arndt-Universität Greifswald
Friedrich-Ludwig-Jahn-Straße 17
D-17489 Greifswald
Telefon +49 3834 864212
[Bitte aktivieren Sie Javascript]
Oder die Pressesprecher
Dr. Manfred Schlösser
Telefon +49 421 2028704
[Bitte aktivieren Sie Javascript]
und Dr. Rita Dunker
Telefon +49 421 2028 856
[Bitte aktivieren Sie Javascript]
Originalartikel:
Metaproteomics of a gutless marine worm and its symbiotic microbial community reveal unusual pathways for carbon and energy use
Manuel Kleiner , Cecilia Wentrup, Christian Lott, Hanno Teeling, Silke Wetzel, Jacque Young, Yun-Juan Chang, Manesh Shah, Nathan C. VerBerkmoes, Jan Zarzycki, Georg Fuchs, Stephanie Markert, Kristina Hempel, Birgit Voigt, Dörte Becher, Manuel Liebeke, Michael Lalk, Dirk Albrecht, Michael Hecker, Thomas Schweder, Nicole Dubilier
Proceedings of the National Academy of Science
doi/10.1073/pnas.1121198109