- Abteilungen
- Abteilung Molekulare Ökologie
- Küstensedimente
Küstensedimente
Projektleiterin
Projektleiterin
MPI für Marine Mikrobiologie
Celsiusstr. 1
D-28359 Bremen
|
Raum: |
2222 |
|
Telefon: |

Unsere Forschung
In diesem Projekt untersuchen wir den Kohlenstoffkreislauf in sandigen Küstensedimenten. Der Schwerpunkt unserer Forschung liegt auf heterotrophen Bakteriengemeinschaften, die in den oxischen Oberflächenschichten leben. So befassen wir uns beispielsweise mit der Frage, ob sich die Saisonalität der Primärproduktion in der Zusammensetzung der benthischen Bakteriengemeinschaft widerspiegelt. Auch die Identifizierung der Hauptnahrungsquellen für benthische heterotrophische Bakterien (Stammt der genutzte Kohlenstoff aus Algen oder Tieren? Gibt es ein Hauptsubstrat und wenn ja, welches ist es?) oder die verschiedenen mikrobiellen Abbauwege für Polysaccharide stehen im Fokus unserer Forschung.
In den Ozeanen nehmen Flachwasserbereiche oder Schelfregionen (bis 200 m Wassertiefe) eine zentrale Rolle im globalen Kohlenstoffkreislauf ein, weil dort etwa ein Fünftel der Primärproduktion stattfindet (Jahnke, 2010). Aufgrund der geringen Wassertiefe sedimentiert ein erheblicher Teil des gebundenden Kohlenstoffs. Der erste Kontakt dieser aus der Wassersäule stammenden organischen Stoffe mit benthischen Mikroorganismen findet an der Sedimentoberfläche statt. Diese Oberflächensedimente fungieren so als biologische Filter und katalysieren zentrale Schritte des Kohlenstoffkreislaufes.
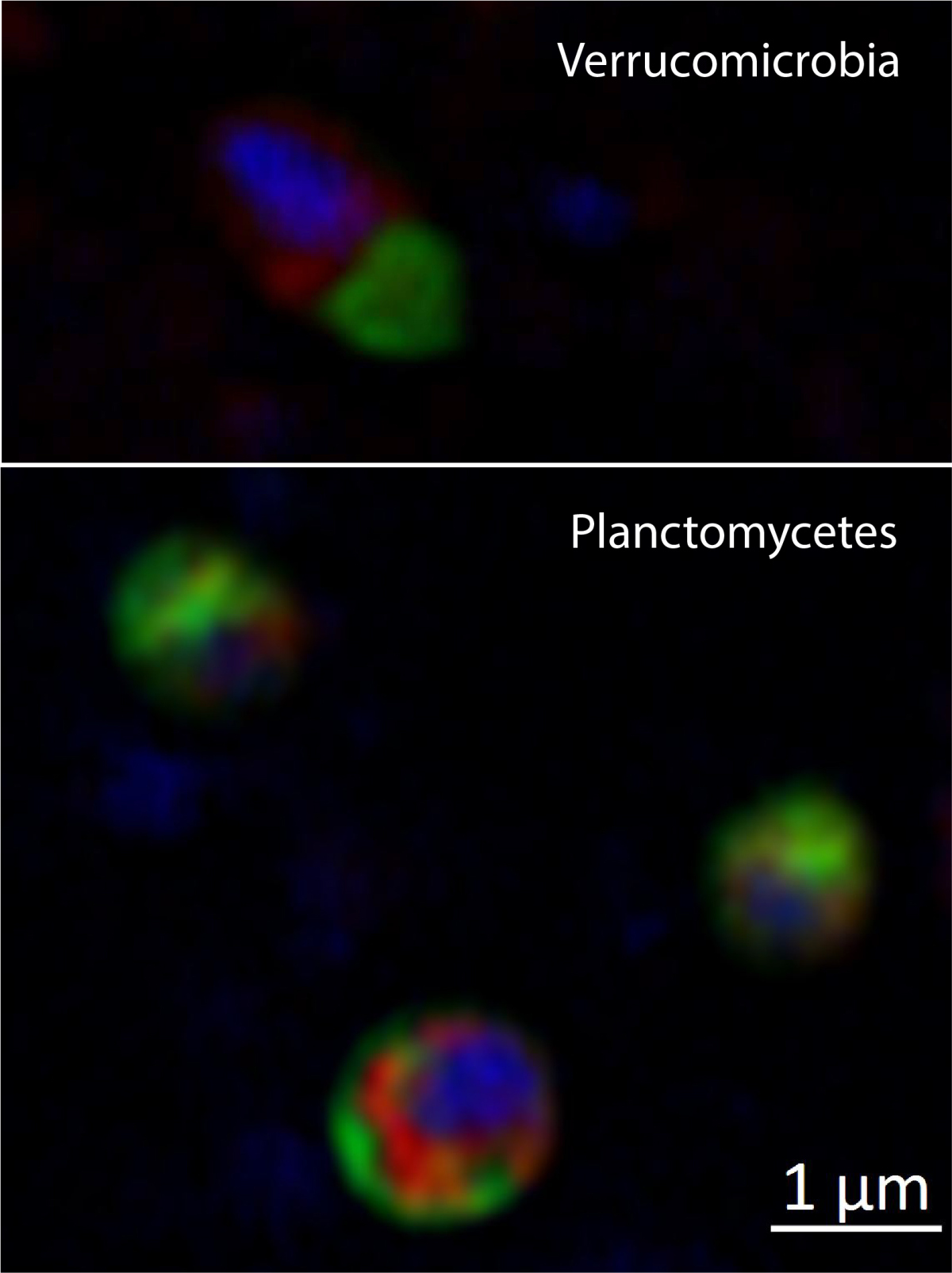
Unsere derzeit wichtigsten Probennahmegebiete liegen bei Helgoland (Nordsee, Deutsche Bucht) und im Isfjord (Spitzbergen, Arktischer Ozean). Erste Analysen zeigten, dass mikrobielle Lebensgemeinschaften in Oberflächensedimenten eine deutliche größere Artenvielfalt als die Lebensgemeinschaften in der Wassersäule aufweisen und sie sich signifikant in ihrer Zusammensetzung unterscheiden (Probandt et al. 2017; Miksch et al., zur Veröffentlichung eingereicht). Die Phyla Planctomycetes, Verrucomicrobia und Actinobacteria werden als Schlüsselbakterien für den Abbau von schwer zersetzbaren Verbindungen mit hohem Molekulargewicht vorgeschlagen.
Im Oktober 2021 haben wir eine Spende der Andreas Rühl Stiftung über 10.000 Euro erhalten. Die Spende unterstützt uns dabei, die hier beschriebene Forschung weiterzuführen.
Wir freuen uns sehr über diese großzügige Unterstützung!
Wie leben Mikroorganismen auf Sandkörnern?
Marine Sedimente bilden den natürlichen Lebensraum für geschätzte 1,7 x 1028 Bakterien und Archaeen (Whitman et al. 1998). In Oberflächensedimenten leben etwa 108 bis 109 Zellen pro Gramm Sediment. Selbst in tiefen Sedimentschichten von wenigen Metern bis hundert Metern sind oft immer noch mehr als 105 Zellen pro Gramm zu finden. Von diesen benthischen Mikroorganismen leben mehr als 99 % angeheftet auf Sandkörnern (Rusch et al. 2003).
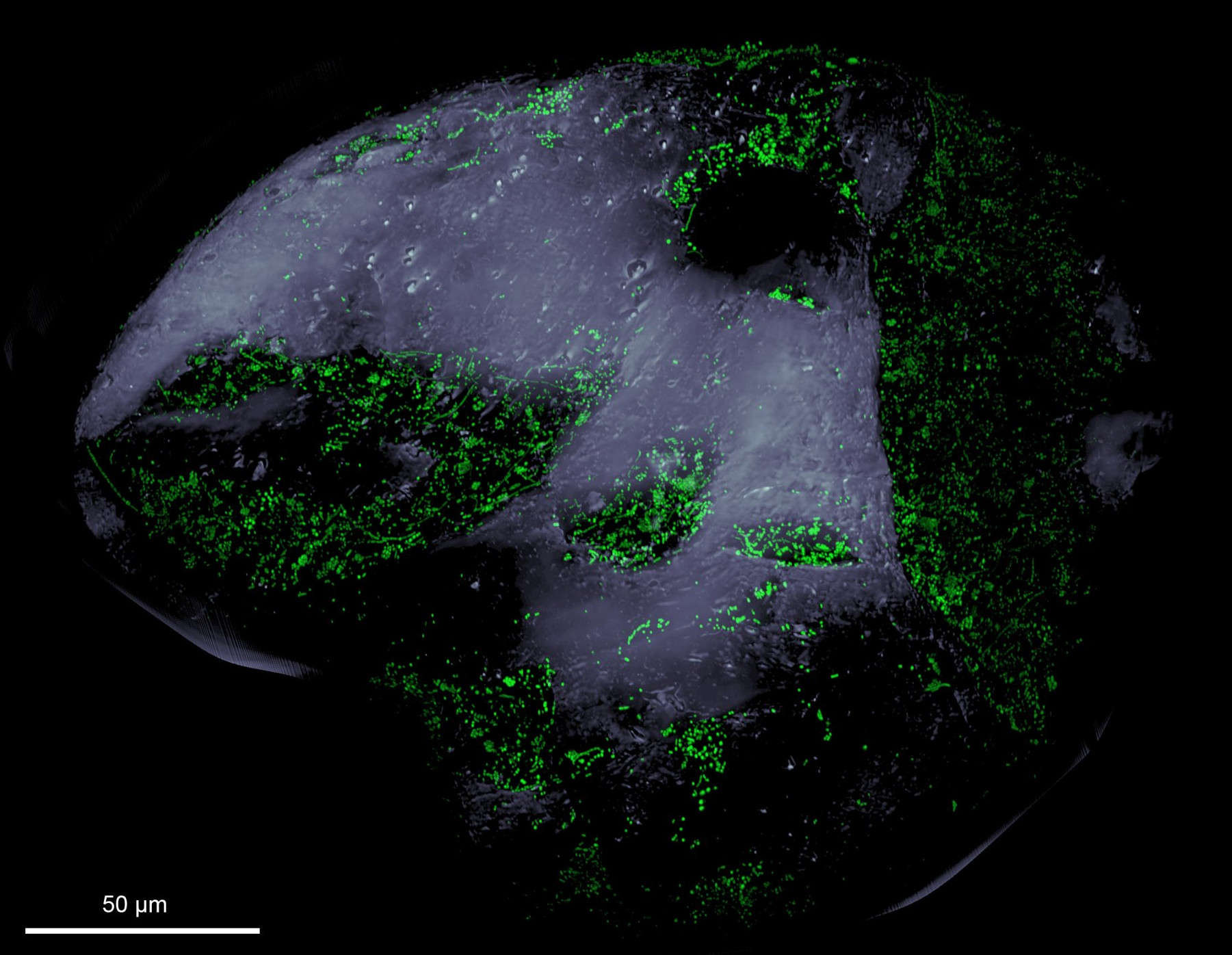
Basierend auf 16S rRNA-Gensequenzierungen zeigte sich, dass in Oberflächensedimenten der Nordsee bis zu 12.000 Bakterienarten leben (Probandt et al. 2017). Betrachtet man ein einzelnes Sandkorn und untersucht die Mikroorganismen direkt in ihrem Mikro-Lebensraum (Probandt et al. 2018) fanden wir die Sandkörner mit jeweils 104–105 Zellen besiedelt. Unsere Ergebnisse zeigen, dass die mikrobielle Lebensgemeinschaft auf einem einzelnen Sandkorn bereits sehr divers ist, was sich durch den Nachweis von mehreren tausend Arten zeigte. Vergleicht man Bakteriengemeinschaften mehrerer Sandkörner miteinander, findet man eine „Stammbewohnerschaft", die auf allen untersuchten Sandkörnern zu finden war und mehr als 50 % aller entdeckter Arten umfasste (Probandt et al. 2018).
Die Oberfläche von Sandkörnern wird nicht flächendeckend von Mikroorganismen besiedelt. Es gibt exponierte Bereiche, die größtenteils frei von Aufwuchs bleiben, und geschützte Bereiche in kleinen Furchen oder Rillen, die dichter besiedelt werden. Die Besiedlung tiefergelegener Bereiche auf der Sandkornoberfläche bietet Schutz vor Abweidung durch wind- und wellenbedingte mechanische Scherkräfte und vermindert den Fraßdruck durch Meio- und Microbenthos.

Mikrobieller Abbau von Polysacchariden
Ein großer Teil des organischen Materials, das in Ozeanen produziert und abgebaut wird, sind Polysaccharide. Diese sind Hauptbestandteile von Makroalgen und Phytoplankton. Über die bakteriellen Abbauwege von Polysacchariden in Sedimenten ist bislang wenig bekannt: Welche Gene sind beteiligt? Wie sind sie organisiert? Unter welchen Bedingungen sind sie besonders stark exprimiert?
Aufgrund der im oberen Abschnitt beschriebenen saisonalen Stabilität der Zusammensetzung benthischer Bakteriengemeinschaften im Jahresverlauf fokussieren wir weitere Untersuchungen auf die Identifizierung von am Polysaccharidabbau-beteiligten Gene sowie auf mögliche Änderungen ihrer Transkription. Kürzlich haben wir begonnen, Expressionsprofile von Glycosidhydrolasen (GH) in Oberflächensedimenten aus Spitzbergen zu untersuchen. Bei 78°N besteht eine starke Saisonalität bezüglich der lichtabhängigen Primärproduktion. Erste metatranskriptomische Analysen zeigen unterschiedliche GH-Expressionsmuster für den polaren Winter (Dezember und Februar) im Vergleich zum polaren Sommer (Ende April/Mai; Miksch, Knittel et al., unveröffentlicht). Eine detailliertere Analyse wird zeigen, ob die Diversität der Glycosidhydrolasen auch im Winter größer ist und welche Polysaccharide als Hauptsubstrate von benthischen heterotrophen Bakterien genutzt werden.
Üblicherweise müssen Polysaccharide außerhalb der Zelle in kleine Teile zerbrochen werden, ehe die Bakterien sie aufnehmen können. Kürzlich konnte jedoch gezeigt werden, dass im Oberflächenwasser des Ozeans ein großer Teil (bis zu 25%) der Bakterien ein egoistisches Essverhalten zeigt (Reintjes et al. 2017): Diese Bakterien binden Polysaccharide an ihre äußere Membran, spalten sie dort mit Glycosidhydrolasen in kleinere Oligosaccharideinheiten und nehmen diese dann über ein Transportersystem (susCD) aktiv ins Periplasma auf. Dort werden sie mit weiteren Glycosidhydrolasen in Monosaccharide gespalten und abschließend über ABC Transporter ins Zytoplasma aufgenommen. Die extrazelluläre Hydrolyse wird im späteren Verlauf einer Phytoplanktonblüte im Frühjahr dann wichtiger (Reintjes et al. 2020).
Die Rolle des egoistischen Aufnahmemodus in benthischen Bakteriengemeinschaften ist bislang nicht untersucht. Vorläufige Analysen unserer Inkubationen von Svalbard Sedimenten mit verschiedenen fluoreszenzmarkierten Polysacchariden zeigen, dass nur ein sehr kleiner Teil der Bakterien egoistisches Essverhalten zeigt, während die extrazellulären Abbauraten für getestete komplexe und weniger komplexe Substrate hoch waren (Knittel, Miksch, Moncada et al., unveröffentlicht).
MPI für Marine Mikrobiologie
Celsiusstr. 1
D-28359 Bremen
|
Raum: |
2224 |
|
Telefon: |


