- Presse
- Pressemeldungen
- Wie ein Industrie-Bakterium Kohlenmonoxid in Biokraftstoff umwandelt
Wie ein Industrie-Bakterium Kohlenmonoxid in Biokraftstoff umwandelt
Wie verwandelt man giftigen Müll in Kraftstoff? Frag das Bakterium! Ein Team aus Forschenden des Max-Planck-Instituts für Marine Mikrobiologie und einem Kollegen vom Max-Planck-Institut für molekulare Zellbiologie und Genetik zeigt nun experimentell, mit welchen molekularen Tricks das Bakterium Clostridium autoethanogenum Industrieabgase in Ethanol umwandelt. Das ist auch wichtig für die nachhaltige Kraftstoff- und Chemikalienproduktion.
Eine rätselhafte Mikrobe im Dienst der grünen Technologie
Das erstmals aus Kaninchenkot isolierte Bakterium Clostridium autoethanogenum kann auf reinem Kohlenmonoxid gedeihen – ein für die meisten Organismen, auch den Menschen, tödliches Gas. Dieses außergewöhnliche Bakterium nutzt das Gift, um aus dem enthaltenen Kohlenstoff Zellmaterial herzustellen, und gewinnt seine Energie aus den nachfolgenden chemischen Reaktionen. Mit Hilfe dieser Reaktionen können wertvolle Chemikalien und Kraftstoffe hergestellt werden, die sich sehr gut für die nachhaltige Biotechnologie eignen.
Obwohl das Bakterium bereits in vielen Industrieanlagen zur Herstellung von Ethanol eingesetzt wird, wusste man bisher nicht, wie die Ethanolproduktion genau abläuft. Ein wichtiger Schritt bei der Reaktion ist vermutlich die Reduktion von Acetat zu Acetaldehyd. Einige Fachleute hielten dies jedoch bei Organismen für nicht machbar. Die nun in Nature Chemical Biology veröffentlichte Studie klärt diesen Widerspruch auf und löst das Rätsel.
Die Acetatreduktion molekular verstehen
Das Enzym, das die anspruchsvolle chemische Reaktion vermutlich durchführt, heißt Aldehyd:Ferredoxin-Oxidoreduktase (AFOR). Es enthält Wolfram, das schwerste in der Biologie vorkommende Atom. Zusätzlich enthält es eine Gruppe aus Eisen und Schwefel, die ihm eine dunkelbraune Farbe verleiht. Mit Hilfe fortschrittlicher Techniken isolierten die Max-Planck-Forschenden das Enzym aus C. autoethanogenum und bestimmten seine atomare Struktur mittels Röntgenkristallographie. Mit der dreidimensionalen Struktur konnten die Forschenden das wolframhaltige Element darstellen und seine Umgebung sehr genau beschreiben. Allerdings gab es ein Problem: Das Enzym war inaktiv. „In langer und harter Arbeit haben wir aber einen Weg gefunden, es zu reaktivieren“, erklärt Olivier Lemaire, der zusammen mit Tristan Wagner die Forschung leitete. „Auf diese Weise konnten wir das Enzym charakterisieren“, fügt, Mélissa Belhamri, ebenfalls Erstautorin der Studie, hinzu. „Es hat eine relativ große Bandbreite an Substraten, was eventuell sogar ermöglicht, neben Ethanol auch andere Alkohole herzustellen.“
Teamwork der Enzyme ermöglicht die schwierige Reaktion
Als nächstes mussten die Forschenden aufklären, wie AFOR eine Reaktion durchführen kann, die eigentlich nicht möglich ist. „Wir wussten, dass das Enzym Acetat aufgrund der Gesetze der Thermodynamik nicht einfach reduzieren würde. Also ließen wir uns von den Tricks inspirieren, die das Bakterium anwendet, wenn es auf Kohlenmonoxid wächst“, sagt Wagner. Die Lösung: Dem AFOR zusätzliche Enzyme zuzumischen. Die Forschenden bauten so im Reagenzglas einen „künstlichen Reaktionsweg“ und produzierten erfolgreich Ethanol aus Acetat. Das bestätigt, dass die gesamte Reaktionssequenz innerhalb der Zelle biologisch machbar ist.
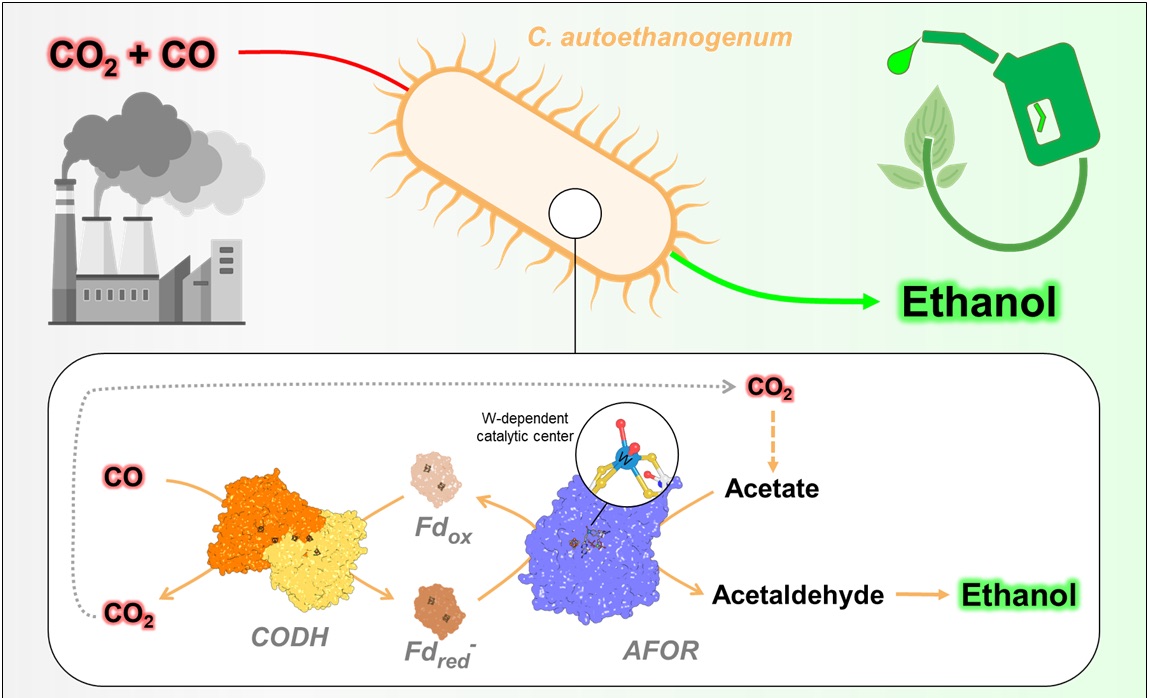
Umwandlung von Abfall in nützliche Produkte
Diese Forschung liefert ein lang ersehntes Teil des metabolischen Puzzles der Ethanolproduktion in diesem Organismus, mit weitreichenden Folgen. „Durch die Entdeckung des Reaktivierungsmechanismus von AFOR, seine molekulare Beschreibung auf atomarer Ebene und unsere Rekonstruktion der Ethanolproduktion wird es möglich sein, den Stoffwechsel von C. autoethanogenum so zu verändern, dass andere nützliche und wertvolle Substanzen aus Industrieabgasen hergestellt werden können“, so Belhamri. Der Prozess kann auch auf andere Organismen übertragen werden. Dies wird die möglichen Quellen für eine mikrobielle Biokraftstoffproduktion drastisch erweitern. „Dies ist ein weiterer Schritt nach vorn bei der Erzeugung grüner Energie durch die biologische Umwandlung von Gasen, ein klarer Fortschritt in der kreislauforientierten Kohlenstoffwirtschaft. Er macht Hoffnung auf eine sauberere und intelligentere Art des Kohlenstoffrecyclings“, schließt Lemaire.
Originalveröffentlichung
Olivier N. Lemaire, Mélissa Belhamri, Anna Shevchenko, and Tristan Wagner (2025): Carbon monoxide-driven bioethanol production operates via a tungsten-dependent catalyst. Nature Chemical Biology, online veröffentlicht 29.10.2025 (online vorab als bioRxiv preprint4. September 2024).
Beteiligte Institutionen
- Max-Planck-Institut für marine Mikrobiologie, Celsiusstraße 1, 28359, Bremen, Deutschland
- Max-Planck-Institut für Molekulare Zellbiologie und Genetik, 01307, Dresden, Deutschland
- Univ. Grenoble Alpes, CEA, CNRS, Institut de Biologie Structurale, 38000, Grenoble, Frankreich
Rückfragen bitte an:
Gruppenleiter
MPI für Marine Mikrobiologie
Celsiusstr. 1
D-28359 Bremen

Pressereferentin
MPI für Marine Mikrobiologie
Celsiusstr. 1
D-28359 Bremen
|
Raum: |
1345 |
|
Telefon: |
