- Presse
- Pressemeldungen
- Winzige Wunder im Ozean
Winzige Wunder im Ozean
Im Hinblick auf die Herkunft des Luftsauerstoffs denken die meisten Menschen zuvorderst an Landpflanzen, insbesondere an die tropischen Regenwälder, die oftmals als die „Grüne Lunge“ der Erde bezeichnet werden. Etwa die Hälfte des Sauerstoffs der Atmosphäre wird jedoch von mikroskopisch kleinen, einzelligen Algen in den Ozeanen produziert. Dieser Sauerstoff wird frei, wenn die Algen Kohlendioxid und Wasser mithilfe von Sonnenlicht zu Biomasse umsetzten (Photosynthese).
Im Gegensatz zu den relativ konstanten Bedingungen in Regenwäldern unterliegt der ozeanische Lebensraum dieser freischwebenden Mikroalgen (Phytoplankton) dynamischen Veränderungen, beispielsweise hinsichtlich der Wassertemperatur, des Sonnenlichts oder des Nährstoffangebots. Die Produktivität des Phytoplanktons ist daher nicht gleichbleibend, sondern gipfelt während Phasen massiver Vermehrung, den sogenannten Phytoplanktonblüten.
Phytoplanktonblüten treten insbesondere in Küstennähe im Frühjahr auf. Zu dieser Zeit sind die Bedingungen zumeist günstig, da die Sonne zusehends länger scheint, und Nährstoffe infolge der Winterpause noch im Überfluss vorhanden sind. Solche Blüten können so gewaltige Ausmaße erreichen, dass sie nur von Satelliten aus in Gänze zu überblicken sind, typischerweise als grünliche Schleier im Meer. Phytoplanktonblüten sind wichtig, denn das Nahrungsnetz und somit das Leben aller Organismen in der sonnendurchfluteten Zone der Meere beruht wesentlich auf der Photosynthese von Algen. Gelegentlich bestehen Phytoplanktonblüten aber auch aus Algen, die Gifte absondern, etwa bei den sogenannten Roten Fluten (engl. „red tides“), welche zu Fischsterben und Strandschließungen führen können.
Wenn einzellige Algen blühen, dann dienen die von ihnen produzierten organischen Verbindungen Bakterien als Nahrung. Auf diese Weise führen Phytoplanktonblüten wiederum zu Blüten unterschiedlichster Bakteriengruppen, die entweder planktonisch, mit Partikeln assoziiert oder in unmittelbarer Nähe der Algen (Phycosphäre) leben. Gemeinsam sind diese Bakterien in der Lage, Algenbiomasse nahezu vollständig abzubauen (Remineralisierung).
Einzellige Mikroalgen mögen winzig sein, aber sie sind in den Ozeanen sehr zahlreich vertreten. Zusammen produzieren sie daher große Mengen an Polysacchariden, auf die sich wiederum viele Bakterienarten spezialisiert haben. Die bakterielle Remineralisierung von Algenpolysacchariden spielt daher eine wesentliche Rolle im globalen Kreislauf des Kohlenstoffs.
Forschende des Max-Planck-Instituts für Marine Mikrobiologie in Bremen, des Alfred-Wegener-Instituts, Helmholtz-Zentrum für Polar- und Meeresforschung in Bremerhaven sowie der Universitäten Bremen und Greifswald haben gemeinsam untersucht, welche Meeresbakterien auf blühende Mikroalgen reagieren. Sie untersuchten dabei insbesondere, wie planktonische Bakterien die verschiedenen Polysaccharide der Algen abbauen und welche Polysaccharide sie dabei bevorzugen. Ihre Ergebnisse präsentieren sie nun in der Fachzeitschrift Microbiome.
Als Untersuchungsort wählten sie die Station „Kabeltonne“ nahe der Insel Helgoland in der Deutschen Bucht. Jedes Frühjahr gib es dort eine Algenblüte. Normalerweise bestehen die Algen zum Großteil aus Kieselalgen (Diatomeen), einer der wichtigsten Gruppen von Mikroalgen, die sich mit robusten Kieselschalen vor Fressfeinden schützen.
„Wir haben von März bis Mai 2020 regelmäßig Proben genommen und die Algen- und Bakterienzusammensetzung analysiert“, erklärt Chandni Sidhu, Erstautorin der Studie. „Wie sich herausstellte, wurde die Frühjahrsblüte im Jahr 2020 von nur drei Arten von Kieselalgen dominiert und durchlief dabei zwei sehr unterschiedliche Phasen. Die ungewöhnlich geringe Algenvielfalt und die zwei deutlich voneinander abgegrenzten Phasen vereinfachten die Analyse sehr. „Normalerweise finden sich solche Bedingungen nur in kontrollierten Laborexperimenten und nicht in einer Küstenumgebung“, so Sidhu. Eine Analyse von Wetterdaten und der Wasserzusammensetzung ergab, dass die zweite Blütephase durch mehrtägige stete Ostwinde verursacht wurde, welche nährstoffreiches Wasser aus den Mündungen der Elbe und Weser bis weit hinaus in die Deutsche Bucht trieben.
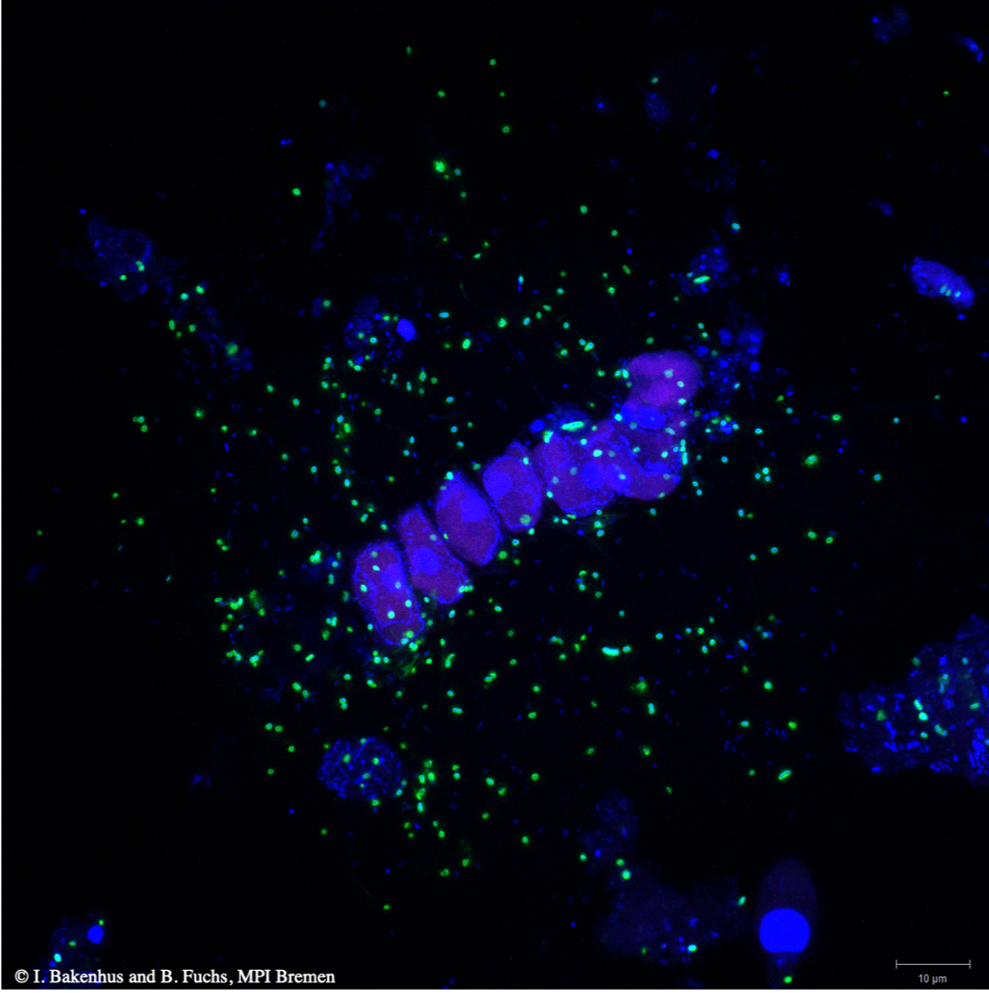
Mittels sogenannter Metagenomik rekonstruierte Sidhu etwa 250 Genome planktonischer Bakterien, welche mit der Blüte in Verbindung standen. Anschließend nutzte sie das Verfahren der Metatranskriptomik, um die Genome der 50 aktivsten Bakterienarten zu bestimmen. Diese Arten gehörten zu wenigen Gruppen (Genera), welche während der Blüte besonders häufig vorkamen. Letzteres konnte im Rahmen des Projekts durch direkte mikroskopische Zellzählung von fluoreszenzmarkierten Bakteriengruppen bestätigt werden.
„Wir konnten nicht nur die Veränderungen in der Zusammensetzung der Bakteriengemeinschaft im Laufe der Zeit verfolgen, sondern auch feststellen, welche Gene ein- und ausgeschaltet wurden, darunter verschiedene Gene für den Abbau von Polysacchariden“, erklärt Sidhu. Eine detaillierte Analyse ergab, dass viele der aktiven Bakterien Laminarin abbauten. Laminarin ist ein strukturell einfaches Beta-Glucan, welches Kieselalgen zur Speicherung biochemischer Energie nutzen. Da Kieselalgen in den Ozeanen besonders zahlreich sind, ist Laminarin eines der am häufigsten vorkommenden Makromoleküle auf der Erde.
Eine zweite Klasse von Polysacchariden, die von aktiven Bakterien konsumiert wurde, waren Alpha-Glucane. Alpha-Glucane werden von einer Vielzahl von Organismen zur Energiespeicherung verwendet, darunter Pflanzen, Tiere, Pilze und Bakterien (z. B. in Form von Stärke oder Glykogen). Anhand ihrer Daten konnte Sidhu zeigen, dass Bakterien der wahrscheinliche Ursprung der Alpha-Glucane sind. “Wenn Bakterien sterben, dann werden ihre Speicherglucane schnell von anderen Bakterien recycelt”, erklärt Sidhu.
Die Forschenden waren überrascht, in welchem Ausmaß die planktonischen Bakterien von leicht abbaubaren Speicherglucanen lebten. “Wir hatten erwartet, dass wir mehr aktive Gene für den Abbau anderer Algenpolysaccharide finden würden. Solche Gene waren zwar vorhanden, aber sie waren überraschend wenig aktiv“, sagt Sidhu. „Planktonische Bakterien ziehen es eindeutig vor, solche Polysaccharide zu verzehren, die löslich, im Überfluss vorhanden und zudem leicht abbaubar sind. Das überlässt viele der komplexeren und schwerer abbaubaren Algenpolysaccharide den an Partikel angehefteten Bakterien.“
Zum ersten Mal konnte das Forschungsteam zeigen, wie Veränderungen der Verfügbarkeit von Laminarin und Alpha-Glucanen die Zusammensetzung der Gemeinschaft blütenassoziierter, planktonischer Bakterien während beider Blütephasen beeinflusste. Insbesondere häufige Bakteriengenera, wie z. B. Aurantivirga, Cd. Prosiliicoccus und Polaribacter, bevorzugten Laminarin und Alpha-Glucane, wodurch sie sich während der Blüte besonders erfolgreich vermehren konnten. Einige dieser Bakterien verfügten über ein sehr ähnliches Repertoire an Genen für den Polysaccharidabbau und konkurrierten daher offensichtlich um dieselbe Nahrungsnische.
Sidhu schlussfolgert: „Diese Art von integrierter Forschung ist nur möglich, wenn Spezialisten aus vielen verschiedenen Bereichen zusammenarbeiten – Biologen unterschiedlichster Fachrichtungen, Bioinformatiker, Chemiker und mathematische Modellierer. Ich bin allen Kollegen unseres Forschungskonsortiums und den assoziierten Partnern dankbar, die diese Studie möglich gemacht haben.“
Originalveröffentlichung
Chandni Sidhu, Inga V. Kirstein, Cédric L. Meunier, Johannes Rick, Vera Fofonova, Karen H. Wiltshire, Nicola Steinke, Silvia Vidal‐Melgosa, Jan‐Hendrik Hehemann, Bruno Huettel, Thomas Schweder, Bernhard M. Fuchs, Rudolf I. Amann & Hanno Teeling (2023): Dissolved storage glycans shaped the community composition of abundant bacterioplankton clades during a North Sea spring phytoplankton bloom. Microbiome 11:77 (2023).
Beteiligte Institutionen
- Max-Planck-Institut für Marine Mikrobiologie, Bremen, Deutschland
- Alfred-Wegener-Institut, Helmholtz-Zentrum für Polar- und Meeresforschung, Helgoland & List auf Sylt, Deutschland
- Universität Bremen, Deutschland
- Universität Greifswald, Deutschland
Rückfragen bitte an:
Gruppenleiter
Forschungsgruppe Durchflusszytometrie
MPI für Marine Mikrobiologie
Celsiusstr. 1
D-28359 Bremen
|
Raum: |
2222 |
|
Telefon: |

Geschäftsführender Direktor
MPI für Marine Mikrobiologie
Celsiusstr. 1
D-28359 Bremen
|
Raum: |
2221 |
|
Telefon: |

Projektleiter
MPI für Marine Mikrobiologie
Celsiusstr. 1
D-28359 Bremen
|
Raum: |
2223 |
|
Telefon: |

Pressereferentin
MPI für Marine Mikrobiologie
Celsiusstr. 1
D-28359 Bremen
|
Raum: |
1345 |
|
Telefon: |