Hochleistungsflüssig-Chromatograph mit Massenspektrometer (HPLC-MS)
Was ist ein Hochleistungsflüssig-Chromatograph mit Massenspektrometer (HPLC-MS)?
Ein Hochleistungsflüssig-Chromatograph gekoppelt an ein Massenspektrometer (HPLC-MS) gehört zu den sensibelsten Geräten, die der Wissenschaft zur Verfügung stehen zur Messung von chemischen Verbindung. Die Analyse kombiniert zwei Trennungsschritte: Erstens die Trennung eines Stoffgemisches auf dem Flüssigchromatographen bei einem Druck von bis zu 1000 bar. Zweitens die Trennung und Detektion von einzelnen Ionen im Hochvakuum des Massenspektrometers. Genau diese Kombination macht es möglich, dass Stoffgemische in ihre Bestandteile aufgetrennt und die Molekülmassen dieser Bestandteile sehr exakt gemessen werden. Ein kleines Bild zur Verdeutlichung: Die Suche nach einer Nadel im Heuhaufen ist deutlich einfacher, wenn man Halme, Blätter und die Nadel voneinander trennen kann. Genau das leistet das Gerät – nur eben für die Welt im Mikrokosmos.
Wie funktioniert ein HPLC-MS?

Es handelt es sich hier um zwei separate Geräte, die miteinander verbunden sind. Bei dem ersten Gerät handelt es sich um den HPLC. Die Flüssigchromatographie trennt Stoffgemische, wie zum Beispiel Muschel-oder Seegrasextrakte in ihre Einzelbestandteile auf. Dazu wird eine kleine Menge verdünnten Extrakts auf eine HPLC-Säule aufgetragen, die aus Mikrometer-großen Kügelchen besteht. Die Kügelchen als Säulenmaterial gibt es in verschiedenen Größen (1,8-5 µm) und Materialien, je nachdem, welche Bestandteile man auftrennen möchte. Die Inhaltsstoffe des Extrakts lagern sich an diese Kügelchen an. Nun wird ein Lösungsmittelgemisch aus beispielsweise Wasser und Acetonitril in sich verändernden Anteilen über die Säule geleitet. Die Inhaltsstoffe des Extraktes, die in ihrer Polarität dem Säulenmaterial gleichen, verweilen auf der Säule, während die Inhaltstoffe, deren Polarität dem Lösungsmittel gleichen, von der Säule gespült werden. Am Ausgang der Säule befindet sich ein UV-Detektor, der UV-aktive Bestandteile des Extraktes detektiert.
Über eine Kapillare ist der Ausgang des UV-Detektors mit der Elektrospray-Quelle (ESI-Quelle) des zweiten Geräts, des Massenspektrometers, verbunden. In dieser Quelle findet die Ionisierung der aufgetrennten Bestandteile des Extraktes statt. An der Kapillare liegt eine Hochspannung an, sodass an der Spitze geladene Tröpfchen entstehen. Ein neutrales Trägergas, wie etwa Stickstoff, wird benutzt, um die Vernebelung der Lösung und das Verdampfen des Lösungsmittels zu unterstützen. Damit zerfallen die Tröpfchen, bis am Ende ionisierte Moleküle übrig bleiben. Im Analysatorteil des Massenspektrometers werden die Ionen nach ihrem Masse/Ladungsverhältnis (m/z) aufgetrennt und am Ende ihrer Flugbahn treffen sie auf einen Detektor, der die Ionen registriert und zählt. Daraus erhält man ein Massenspektrum, das die Signale (Peaks) nach ihrem m/z Verhältnis ordnet und ihre Intensität darstellt. Gerade bei einer ESI-Ionisierung entstehen häufig mehrfach geladene Ionen. Dabei wird ein doppelt geladenes Ion bei der Hälfte seiner eigentlichen Masse detektiert, da sie nach dem m/z Verhältnis getrennt wurden.
HPLC-MS macht es möglich, eine hohe Probenanzahl in einer kurzen Zeit zu analysieren. Das beinhaltet sowohl die Identifikation (Was ist die Substanz?) also auch die Quantifizierung der Moleküle in der Probe (Wieviel von der Substanz ist in der Probe?). Ersteres erfolgt meist über Vergleiche mit Datenbanken oder Referenzsubstanzen, zweiteres über die Zugabe interner Standards und das Erstellen von Kalibrierkurven.
Der HPLC-MS in der Lehre
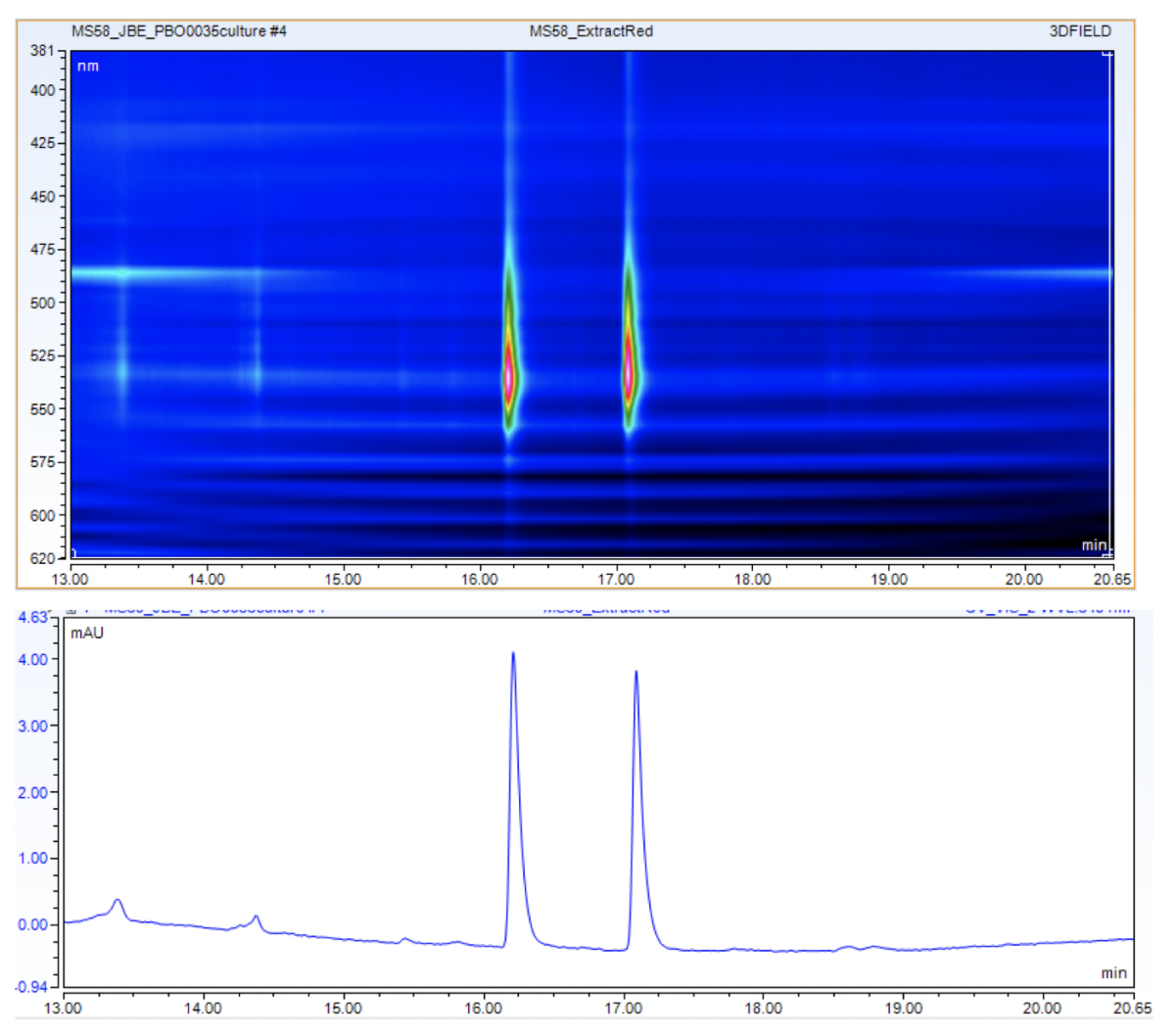
Das Kultivieren und Charakterisieren von Mikroorganismen ist ein wichtiger Teil des Masterstudiums MarMic, das federführend vom Max-Planck-Institut für Marine Mikrobiologie unterrichtet wird. Viele der Mikroorganismen im Meer produzieren Pigmente (Farbstoffe), die wir im Kurspraktikum mit den Studierenden untersuchen. Gelingt es den Studierenden, einen Pigment-produzierenden Mikroorganismus zu isolieren, wird dieser zunächst in einem reichhaltigen Medium mit Traubenzucker und Hefeextrakt angezogen (Bild links). Als nächstes werden nacheinander Methanol, Chloroform und Wasser als Lösungsmittel dazugegeben, wodurch die Pigmente aus den Zellen des Mikroorganismus gelöst werden können. Da sich Methanol/Wasser und Chloroform nicht miteinander mischen, bilden sich zwei Phasen aus (Bild Mitte). So können die Pigmente von den Zellen getrennt werden und dieser Extrakt mit HPLC-MS analysiert werden.
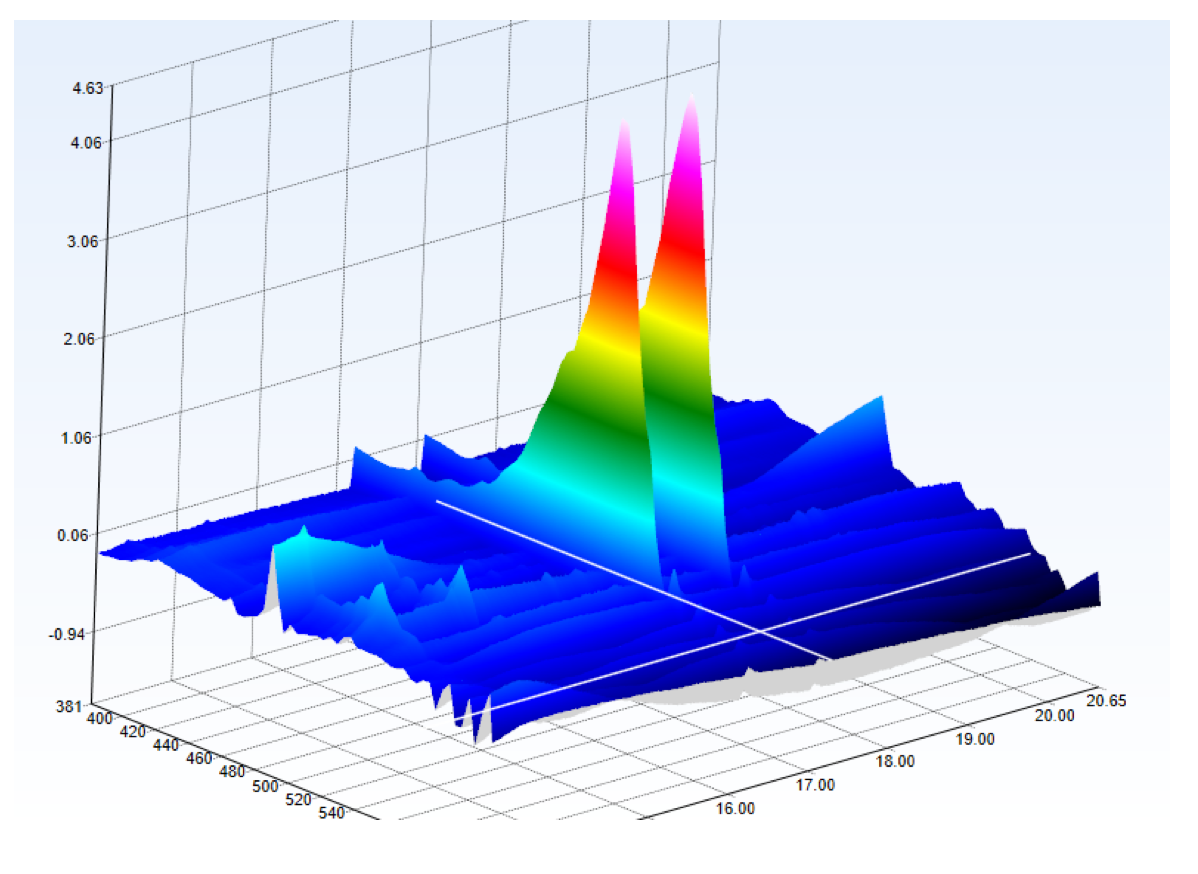
Nachdem die Farbpigmente auf der Säule aufgetrennt wurden, werden sie vom UV-Detektor detektiert, da sie UV-Strahlung absorbieren. Quasi zeitgleich werden die aufgetrennten Farbpigmente in der Quelle ionisiert, im Massenspektrometer nach ihrem Masse/Ladungsverhältniss aufgetrennt und detektiert. Die Studierenden haben nun die Möglichkeit, Molekülstrukturen und detektierte Molekülmassen abzugleichen. Die exakte Molekülmasse erlaubt in vielen Fällen die genaue Bestimmung des Pigmentes und damit die Beschreibung einer wichtigen Eigenschaft des isolierten Mikroorganismus.
Wer nutzt den HPLC-MS?
Verwendet wird das Gerät vor allem von Mitgliedern der Gruppe Metabolische Interaktionen. Aber auch andere Wissenschaftlerinnen und Wissenschaftler des Instituts haben die Möglichkeit, das Instrument für ihre Forschung zu nutzen, etwa aus der Abteilung Symbiose oder aus der Brückengruppe Marine Glykobiologie.
Kontakt
Technische Angestellte
MPI für Marine Mikrobiologie
Celsiusstr. 1
D-28359 Bremen
|
Raum: |
2506 |
|
Telefon: |